سندروم گیلن باره چیست؟
سندروم گیلن باره (Guillain–Barré syndrome/GBS) نوعی ضعف عضلانی با آغازی سریع است که به دلیل آسیب اعصاب محیطی توسط سیستم ایمنی، ایجاد می شود. به طور معمول، هر دو طرف بدن درگیر هستند و علائم اولیه شامل تغییرات در حس یا درد – اغلب در پشت بدن – همراه با ضعف عضلانی است که از پاها و دست ها شروع شده و غالباً به بازوها و قسمت فوقانی بدن گسترش می یابد. علائم ممکن است در عرض چند ساعت تا چند هفته ظاهر شوند. این اختلال در مرحله حاد می تواند تهدید کننده حیات باشد؛ زیرا حدود 15 درصد از بیماران دچار ضعف عضلات تنفسی شده و بنابراین به تهویه مکانیکی نیاز پیدا می کنند. عملکرد سیستم عصبی خودمختار در برخی از بیماران تغییر پیدا می کند که خود می تواند منجر به ناهنجاری های خطرناکی در ضربان قلب و فشار خون شود.
اگرچه علت این بیماری ناشناخته است اما مکانیسم زمینه ای آن یک اختلال خودایمنی است که در آن سیستم ایمنی بدن به اشتباه به اعصاب محیطی حمله کرده و به پوشش میلین آنها آسیب می رساند. این اختلال سیستم ایمنی گاهی اوقات در اثر عفونت یا به احتمال کمتری توسط جراحی و یا به ندرت با واکسیناسیون ایجاد می شود. تشخیص این بیماری معمولاً بر اساس علائم و نشانه ها و رد دیگر علل محتمل انجام شده و با آزمایش هایی نظیر مطالعات هدایت عصبی (Nerve conduction study) و بررسی مایع مغزی-نخاعی حمایت می شود. این بیماری بر اساس مناطق دچار ضعف، نتایج مطالعات هدایت عصبی و وجود آنتی بادی های خاص، به زیرگروه هایی تقسیم می شود. این بیماری به عنوان یک پلی نوروپاتی حاد (Acute polyneuropathy) طبقه بندی می گردد.
درمان سریع با ایمونوگلوبولین های درون وریدی (Intravenous immunoglobulin/IVIG) یا تعویض پلاسما (Plasmapheresis)، در کنار مراقبت های حمایتی، باعث بهبودی مطلوبی در اکثریت مبتلایان به ضعف شدید می شود. بهبودی ممکن است هفته ها تا سال ها طول بکشد و حدود یک سوم بیماران ضعف دائمی دارند. تقریباً 7.5 درصد از مبتلایان، در سطح جهانی، در اثر این بیماری می میرند. سندروم گیلن باره نادر است و سالانه یک یا دو نفر در هر صدهزار نفر به این بیماری مبتلا می شوند. نرخ بیماری در هر دو جنس و نیز در همه نقاط جهان مشابه است.
نام این سندروم برگرفته از متخصصین مغز و اعصاب فرانسوی، ژرژ گیلن (Georges Guillan) و ژان الکساندر باره (Jean Alexandre Barré) است که این بیماری را در سال 1916 به همراه پزشک فرانسوی آندره استرول (André Strohl)، توصیف کردند.
تاریخچه سندروم گیلن باره
ژرژ گیلن، همراه با باره و استرول، دو مورد از فلج حاد خود محدود شونده را همراه با تغییراتی عجیب در مایع مغزی-نخاعی شرح دادند. او در سال 1925 جانشین معلم خود، پیر ماری (Pierre Marie)، به عنوان استاد مغز و اعصاب در بیمارستان سالپتریه (Salpêtrière) در پاریس شد.
ژان باپتیست اکتاو لاندری (Jean-Baptiste Octave Landry) این اختلال را اولین بار در سال 1859 توصیف کرد. در سال 1916، ژرژ گیلن، ژان الکساندر باره و آندره استرول دو سرباز را با این بیماری تشخیص دادند و اختلال کلیدی برای تشخیص این بیماری – تفکیک آلبومینوسیتولوژیکی – که افزایش غلظت پروتئین مایع نخاعی اما تعداد طبیعی سلول ها می باشد را توصیف کردند.
سی. میلر فیشر (C. Miller Fisher) در سال 1956 نوعی از بیماری را توصیف کرد که هم اکنون به نام او می باشد. ادوین بیکرستاف (Edwin Bickerstaff)، متخصص مغز و اعصاب انگلیسی، نوع انسفالیت را در سال 1951 توصیف نمود و در سال 1957 با انتشار مقاله دیگری، به درک این نوع از بیماری بار دیگر کمک کرد. گیلن برخی از این ویژگی ها را قبل از شرح کامل آنها در سال 1938 گزارش کرده بود. از آن زمان تاکنون زیرگروه های دیگری شرح داده شده است؛ مانند نوعی که آتاکسی خالص دارد و نیز نوع ایجاد کننده ضعف حلقی، گردنی و بازویی. زیرگروه آکسونی برای اولین بار در سال 1986 توصیف شد.
معیارهای تشخیصی این بیماری در اواخر دهه 1970 پس از شناسایی مجموعه موارد مرتبط با واکسیناسیون آنفولانزای خوکی ایجاد شد. این معیارها در سال 1990 اصلاح شدند. تعریف مورد توسط بنیاد همکاری برایتون (Brighton Collaboration) برای ایمنی واکسن در سال 2009 تجدید نظر شد، اما عمدتاً برای تحقیقات در نظر گرفته شده است. تعویض پلاسما برای اولین بار در سال 1978 مورد استفاده قرار گرفت و مزایای آن در مطالعات بزرگتری در سال 1985 تأیید شد. ایمونوگلوبولین های درون وریدی در سال 1988 معرفی شدند و مطالعات در اوایل دهه 1990 نشان داد که تأثیر آنها کمتر از تبادل پلاسما نمی باشد.
مسیرهای پژوهشی
درک مکانیسم بیماری سندروم گیلن باره در سال های اخیر پیشرفت داشته است. توسعه درمان های جدید از زمان معرفی ایمونوتراپی در دهه 1980 و 1990، محدود بوده است. هدف تحقیقات کنونی این است که نشان دهند آیا برخی از افرادی که IVIg دریافت کرده اند ممکن است در صورتی که سطح آنتی بادی اندازه گیری شده در خون پس از انجام درمان فقط کمی افزایش داشته باشد، از دوره دوم درمان سود ببرند؟ مطالعات بر روی داروهای سرکوب کننده سیستم ایمنی مایکوفنولات موفتیل (Mycophenolate mofetil)، فاکتور نورون زایی مشتق شده از مغز (Brain-derived neurotrophic factor) و اینترفرون بتا (IFN-β) مزایایی برای آنها نشان نداده که بتوانند از حمایت گسترده ای برخوردار شوند.
اغلب برای مطالعات از یک مدل حیوانی (نوریت خودایمنی تجربی (Experimental autoimmune neuritis) در موش صحرایی) استفاده می شود. نشان داده شده که برخی از عوامل امیدوار کننده هستند: گلاتیرامر استات (Glatiramer acetate)، کینپرامین (Quinpramine)، فاسودیل (Fasudil) (مهار کننده آنزیم روکیناز (Rho-kinase))، و داروی قلبی فلکائینید (Flecainide). استفاده از آنتی بادی برای هدف قرار دادن آنتی بادی ضد گانگلیوزیدی anti-GD3 در تحقیقات آزمایشگاهی سودمند بوده است. با توجه به نقش سیستم کمپلمان در گیلن باره، این موضوع مطرح شده که مهار کننده های کمپلمان (مانند داروی اکولیزوماب (Eculizumab)) می توانند برای این بیماری مؤثر باشند.
اپیدمیولوژی سندروم گیلن باره
در کشورهای غربی، تعداد دوره های سالانه جدید بین 0.89 تا 1.89 مورد در هر صدهزار نفر تخمین زده شده است. کودکان و بالغین جوان با احتمال کمتری نسبت به افراد مسن مبتلا می شوند: خطر نسبی با گذشت هر دهه از زندگی 20 درصد افزایش می یابد. مردان بیشتر از زنان به سندروم گیلن باره مبتلا می شوند. خطر نسبی برای مردان در مقایسه با زنان 1.78 است.
توزیع زیرگروه ها بین کشورهای مختلف متفاوت است. در اروپا و ایالات متحده، 60-80 درصد از بیماران سندروم گیلن باره مبتلا به نوع دمیلینه کننده (AIDP) هستند و AMAN فقط تعداد کمی (6-7 درصد) را درگیر می کند. در آسیا و آمریکای مرکزی و جنوبی، نسبت AMAN به طور قابل توجهی بیشتر است (30 تا 65 درصد) که ممکن است مربوط به قرار گرفتن در معرض انواع مختلف عفونت ها، و یا ویژگی های ژنتیکی آن جمعیت، باشد. گمان بر این است که نوع میلر فیشر بیشتر در آسیای جنوب شرقی رایج است.
علائم و نشانه های سندروم گیلن باره
اولین علائم سندروم گیلن باره شامل بی حسی، گزگز و درد، چه به تنهایی چه در ترکیبی با این علائم، می باشد. سپس پاها و دست ها دچار ضعف می شوند. این ضعف هر دو طرف بدن را به یک اندازه تحت تأثیر قرار می دهد و با گذشت زمان بدتر می گردد. ممکن است نصف یک روز تا بیش از دو هفته زمان لازم باشد تا ضعف به حداکثر شدت خود برسد و سپس در این شدت به صورت ثابت باقی بماند. از هر پنج نفر، ضعف در یک نفر تا چهار هفته ادامه می یابد. ماهیچه های گردنی نیز ممکن است درگیر شوند. اعصاب مغزی تأمین کننده سر و صورت در حدود نیمی از افراد دچار مشکل می شوند که ممکن است منجر به ضعف عضلات صورت، اختلالات بلع و گاهی ضعف عضلات چشم شود. در 8 درصد از بیماران، ضعف فقط در پاها رخ می دهد (پاراپلژی). اختلال عضلات کنترل کننده مثانه و مقعد غیرمعمول است. در مجموع، حدود یک سوم افراد مبتلا به سندروم گیلن باره همچنان قادر به راه رفتن هستند. به محض اینکه پیشرفت ضعف متوقف شود، در سطح ثابتی (“مرحله کفه (Plateau phase)”) باقی مانده و سپس بهبود می یابد. مرحله کفه می تواند بین دو روز تا شش ماه طول بکشد، اما به طور معمول مدت آن یک هفته است. علائم مرتبط با درد بیش از نیمی از بیماران را درگیر می کند و شامل درد در پشت، گزگز دردناک، درد عضلانی و درد در سر و گردن – به علت تحریک لایه های پوشاننده مغز – می باشد.
بسیاری از بیماران مبتلا به سندروم گیلن باره 3 تا 6 هفته قبل از شروع علائم عصبی، علائم و نشانه های نوعی عفونت را تجربه کرده اند که ممکن است عفونت دستگاه تنفسی فوقانی (رینیت، گلودرد) یا اسهال باشد.
تشخیص بیماری در کودکان، به ویژه آنهایی که زیر شش سال هستند، ممکن است دشوار باشد و در ابتدا وضعیت کودک غالباً با سایر علل ایجاد کننده درد و مشکلات راه رفتن، مانند عفونت های ویروسی یا مشکلات استخوانی و مفصلی، اشتباه گرفته می شود (گاهی تا دو هفته).
ویژگی های مشخص بیماری در معاینه عصبی عبارتند از: کاهش قدرت ماهیچه ها و نیز کاهش رفلکس های تاندونی (هایپورفلکسی) یا عدم وجود آن ها (آرفلکسی). با این حال در اندام های درگیر بخش کوچکی از بیماران، قبل از ایجاد آرفلکسی، رفلکس های طبیعی وجود دارند. در برخی از بیماران نیز ممکن است رفلکس های تشدید شده وجود داشته باشند. در نوع میلر فیشر (Miller Fisher) از سندروم گیلن باره (در ادامه مشاهده کنید)، سه گانه ضعف عضلات چشم، اختلالات تعادل و همچنین عدم وجود رفلکس ها یافت می شود. در سندروم گیلن باره سطح هوشیاری به طور معمول درگیر نمی شود، اما در زیرگروه انسفالیت ساقه مغز بیکراستاف (Bickerstaff brainstem encephalitis) ممکن است بیمار دچار خواب آلودگی یا کما بشود.
نارسایی تنفسی
یک چهارم بیماران مبتلا به سندروم گیلن باره دچار ضعف عضلات تنفسی می شوند که خود منجر به نارسایی تنفسی و ناتوانی در تنفس کافی برای حفظ سطح سالم اکسیژن یا دی اکسید کربن در خون می شود. این سناریوی تهدید کننده حیات با وقوع مشکلات دیگری مانند ذات الریه یا پنومونی، عفونت های شدید، لخته خون در ریه ها و خونریزی در دستگاه گوارش، در 60 درصد از افرادی که به تهویه مصنوعی نیاز دارند، عارضه دار می شود.
اختلال عملکرد سیستم عصبی خودمختار
سیستم عصبی خودمختار یا غیر ارادی، که در کنترل عملکردهای بدن مانند ضربان قلب و فشار خون نقش دارد، در دو سوم از افراد مبتلا به سندروم گیلن باره درگیر می شود؛ اما اثرات آن متغیر است. بیست درصد از بیماران ممکن است نوسانات شدید فشار خون و بی نظمی هایی در ضربان قلب تجربه کنند؛ گاهی اوقات این بی نظمی ها تا حدی است که ضربان قلب فرد متوقف می شود و بیمار به دستگاه ضربان ساز نیاز پیدا می کند. سایر مشکلات مرتبط عبارت اند از ناهنجاری در تعریق و تغییر در واکنش پذیری مردمک ها. اختلال سیستم عصبی خودمختار حتی می تواند بر کسانی که ضعف عضلانی شدیدی ندارند نیز تاثیر بگذارد.
علت سندروم گیلن باره
شروع با عفونت
دو سوم بیماران مبتلا به سندروم گیلن باره، قبل از شروع بیماری دچار عفونت شده بودند که در بیشتر موارد دوره هایی از گاستروانتریت (عفونت دستگاه گوارش) یا عفونتی در دستگاه تنفسی است. در بسیاری از موارد می توان ماهیت دقیق عفونت را مشخص کرد. این سندروم تقریباً در 30 درصد بیماران توسط باکتری کمپیلوباکتر ژژونی (Campylobacter jejuni)، که باعث اسهال می شود، ایجاد می گردد. 10 درصد دیگر مربوط به سایتومگالوویروس (Cytomegalovirus) (CMV، HHV-5) است. با این وجود تعداد بسیار کمی از مبتلایان به عفونت کمپیلوباکتر یا CMV، به سندروم گیلن باره مبتلا می شوند (به ترتیب 0.25-0.65 و 0.6-2.2 در هر هزار دوره از عفونت). سویه کمپیلوباکتر ممکن است خطر ابتلا به GBS را تعیین کند؛ اشکال مختلف باکتری ها، لیپوپلی ساکاریدهای متفاوتی در سطح خود دارند و برخی ممکن است باعث بیماری شوند (به ادامه مطلب مراجعه کنید) در حالی که برخی دیگر این گونه نیستند.
ارتباط بین سایر عفونت ها و گیلن باره قطعیت کمتری دارد. دو هرپس ویروس (Herpesvirus) دیگر (ویروس اپشتین-بار (Epstein-Barr virus)/HHV-4 و ویروس آبله مرغان یا واریسلا زوستر (Varicella zoster)/HHV-3)) و باکتری مایکوپلاسما پنومونیه (Mycoplasma pneumonia) با گیلن باره ارتباط داشته اند. می دانیم که گیلن باره پس از ابتلا به آنفولانزا رخ می دهد و واکسیناسیون آنفلوانزا با کاهش خطر ابتلا به گیلن باره مرتبط است. تب دنگی (Dengue fever) و ویروس زیکا (Zika virus)، عفونت های فلاوی ویروسی (Flavivirus) مناطق گرمسیری، نیز با دوره های گیلن باره مرتبط می باشند. مشخص شده است که عفونت قبلی با ویروس هپاتیت E در افراد مبتلا به گیلن باره شایع تر است.
گزارش شده که گیلن باره با COVID-19 مرتبط است و ممکن است عارضه عصبی بالقوه ای برای این بیماری باشد.
شروع با واکسن
به دنبال ایمن سازی آنفولانزا که در پی شیوع آنفولانزای خوکی در سال 1976 (H1N1 A/NJ/76) رخ داد، افزایش نرخ بروز سندروم گیلن باره مشاهده شد؛ 8.8 نفر از هر یک میلیون نفر ایمن شده (0.0088 در هر هزار نفر) به این عارضه دچار شدند. در طی 6 هفته پس از واکسیناسیون آنفلوانزا، GBS در 362 نفر از 45 میلیون نفر واکسینه رخ داد، که نسبت به حالت عادی 8.8 برابر افزایش یافته است. GBS ناشی از واکسیناسیون آنفولانزای خوکی در سال 1976 داده پرت محسوب می شود؛ چرا که در کمپین های بعدی واکسیناسیون، افزایش ناچیزی در میزان بروز GBS مشاهده شد که به آن میزان قبلی نبود. واکسن همه گیری آنفلوانزای 2009 در برابر ویروس همه گیر آنفلوانزای خوکی H1N1/PDM09 باعث افزایش قابل توجهی در تعداد بیماران نشد. در واقع “مطالعات نشان داد که افزایش کوچکی بالاتر از مقدار پایه، به میزان تقریباً 1 مورد در هر یک میلیون واکسینه، وجود دارد، که مشابه مواردی است که پس از تجویز واکسن های آنفلوانزای فصلی در چند سال گذشته مشاهده شده است.” مزیت واکسیناسیون در پیشگیری از آنفولانزا برای جمعیت به عنوان یک کل، بیشتر از خطرات کوچک آن برای افراد مبتلا به GBS پس از واکسیناسیون است. خود عفونت طبیعی آنفولانزا نسبت به واکسیناسیون آنفولانزا خطر بیشتری برای ابتلا به گیلن باره دارد و واکسیناسیون با کاهش خطر ابتلا به آنفولانزا، خطر ابتلا به گیلن باره را به طور کلی کاهش می دهد.
در ایالات متحده، گیلن باره ای که به دنبال واکسیناسیون آنفلوانزای فصلی می آید، در جدول آسیب های واکسن (Vaccine injury list) دولت فدرال قید شده است.
گیلن باره به عنوان یک عارضه جانبی بسیار نادر واکسن جانسن (Janssen) برای COVID-19 گزارش شده است.
ناشی از دارو
زیملیدین ، یک داروی ضدافسردگی است که ویژگی ایمنی بسیار مطلوبی داشت اما در نتیجه موارد نادر گزارش سندروم گیلن باره از بازار حذف شد.
مکانیسم سندروم گیلن باره
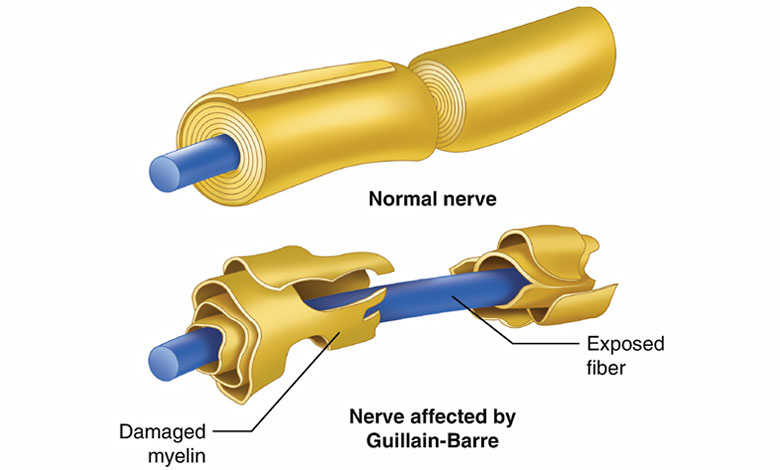
اختلال عملکرد اعصاب در سندروم گیلن باره، در اثر حمله سیستم ایمنی به سلول های عصبی سیستم اعصاب محیطی و ساختارهای حمایت کننده آنها ایجاد می شود. جسم سلولی سلول های عصبی (سوما (Soma)) در نخاع قرار دارد. این سلول ها همچنین استطاله بلندی (آکسون) دارند؛ استطاله ای که تکانه های الکتریکی اعصاب را به اتصالات عصبی-عضلانی، جایی که تکانه به ماهیچه وارد می شود، منتقل می کند. آکسون ها در غلاف میلین دار سلول های شوان (Schwann cells) پیچیده شده اند. بین سلول های شوان فضاهایی خالی وجود دارد (گره های رانویه (Nodes of Ranvier)) که آکسون در آنجا نمایان می شود. انواع مختلف سندروم گیلن -باره نشان دهنده انواع مختلف حملات سیستم ایمنی هستند. در نوع از بین برنده میلین یا دمیلینه کننده (Demyelinating) (AIDP، به ادامه مطلب مراجعه کنید) گلبول های سفید خون (لنفوسیت های T و ماکروفاژها) به غلاف میلین آسیب می زنند. قبل از این فرآیند، گروهی از پروتئین های خون که به عنوان کمپلمان (Complement) شناخته می شوند، فعال می گردند. در مقابل، در نوع آکسونی، غشای سلولی پوشاننده آکسون توسط آنتی بادی های IgG و کمپلمان ها – بدون دخالت لنفوسیت ها – مورد حمله قرار می گیرد.
در سندروم گیلن باره آنتی بادی های مختلفی علیه سلول های عصبی گزارش شده اند. نشان داده شده که در زیرگروه آکسونی، این آنتی بادی ها به گانگلیوزیدها (Gangliosides)، گروهی از مواد موجود در اعصاب محیطی، متصل می شوند. گانگلیوزید یک مولکول متشکل از سرامید (Ceramide) است که به گروه کوچکی از قندهای نوع هگزوز متصل شده و تعداد متغیری از گروه های ان-استیل نورامینیک اسید (N-acetylneuraminic acid) دارد. چهار گانگلیوزید کلیدی که آنتی بادی ها علیه آنها ساخته می شوند عبارتند از:GM1 ،GD1a ، GT1a و GQ1b. هر یک از آنتی بادی های ضد گانگلیوزیدی مختلف با ویژگی های خاصی مرتبط هستند. به عنوان مثال آنتی بادی های anti-GQ1b با نوع میلر فیشر GBS و اشکال مرتبط از جمله انسفالیت بیکراستاف مرتبط است. احتمالاً فرآیند تقلید مولکولی (Molecular mimicry) موجب تولید این آنتی بادی ها پس از عفونت می شود. در این فرآیند سیستم ایمنی بدن با تولید آنتی بادی به مواد میکروبی واکنش نشان می دهد، اما آنتی بادی های حاصله با مواد طبیعی بدن نیز واکنش نشان می دهند. بدن پس از عفونت با کمپیلوباکتر آنتی بادی های کلاس IgA تولید می کند. تنها تعداد کمی از مردم علیه مواد موجود در دیواره سلولی باکتریایی (مانند لیپوالیگوساکاریدها (Lipooligosaccharides))، آنتی بادی IgG تولید می کنند که با گانگلیوزیدهای سلول عصبی انسان واکنش متقاطع دارند. در حال حاضر مشخص نیست که چگونه این فرآیند از تحمل یا تولرانس مرکزی (Central tolerance) – که وظیفه اش سرکوب تولید آنتی بادی های ضد مواد خود بدن است – فرار کرده و با گانگلیوزیدها واکنش نشان می دهد. همه آنتی بادی های ضد گانگلیوزیدی باعث بیماری نمی شوند و اخیراً نشان داده شده که برخی آنتی بادی ها به طور هم زمان به بیش از یک نوع اپی توپ (Epitope) متصل می شوند (اتصال هترودیمر (Heterodimeric binding)) و این چیزی است که پاسخ را تعیین می کند. به علاوه، تشکیل آنتی بادی های بیماری زا ممکن است به وجود سایر سویه های باکتری در روده وابسته باشد.
تشخیص سندروم گیلن باره
تشخیص سندروم گیلن باره به یافته هایی مانند فلج سریع عضلانی، عدم وجود رفلکس ها، عدم وجود تب و عدم وجود سایر علل محتمل بستگی دارد. تجزیه و تحلیل مایع مغزی-نخاعی (از طریق پونکسیون کمری (Lumbar spinal puncture)) و مطالعات هدایت عصبی، از تشخیص پزشک حمایت می کنند و معمولاً در فرآیند تشخیص GBS انجام می شوند. آزمایش آنتی بادی های ضد گانگلیوزیدی در بیشتر موارد انجام می شود اما نقش آنها در تشخیص بیماری معمولاً محدود است. آزمایش خون به طور کلی برای رد دیگر علل محتمل ضعف – مانند سطح پایین پتاسیم در خون – انجام می شود. سطح سدیم خونی اغلب در سندروم گیلن باره به طور غیرطبیعی پایین می باشد که گفته می شود احتمالاً علت آن ترشح نامناسب هورمون ضد ادراری (Antidiuretic hormone) بوده چرا که این هورمون منجر به احتباس نسبی آب می شود.
تصویربرداری تشدید مغناطیسی یا MRI از نخاع در بسیاری از موارد برای تمایز بین سندروم گیلن باره و سایر عللی که موجب ضعف اندام می شوند، مانند فشردگی نخاع (Spinal compression)، انجام می شود. تجمع ماده حاجب در ریشه های عصبی (Nerve root enhancement) در اسکن MRI ممکن است نشان دهنده گیلن باره باشد. این ویژگی در 95 درصد اسکن های کودکان وجود دارد اما اختصاصی سندروم گیلن باره نیست و باید به شیوه دیگری نیز تأیید شود.
مایع نخاعی
مایع مغزی-نخاعی، مغز و ستون فقرات را در بر می گیرد و در پونکسیون کمری یا اسپاینال تپ (Spinal tap)، مقدار کمی مایع با استفاده از سوزنی که بین مهره های کمری وارد شده است، برداشته می شود. افزایش سطح پروتئین معمولاً بیشتر از 0.55 گرم در لیتر و تعداد گلبول های سفید کمتر از 10 عدد در هر میلی متر مکعب از مایع مغزی-نخاعی، مشخصه سندروم گیلن باره است (“تفکیک آلبومینوسیتولوژیکی (Albuminocytological dissociation)”). این الگو سندروم گیلن باره را از سایر بیماری ها (مانند لنفوم و فلج اطفال) متمایز می کند چرا که در آن ها تعداد پروتئین ها و سلول ها افزایش می یابد. افزایش سطح پروتئین مایع مغزی-نخاعی تقریباً در 50٪ بیماران در 3 روز اول و در 80% درصد بیماران پس از هفته اول مشاهده می شود.
انجام مکرر پونکسیون کمری در طول دوره بیماری توصیه نمی شود. سطح پروتئین ممکن است پس از درمان افزایش یابد.
نوروفیزیولوژی
ارزیابی مستقیم هدایت تکانه های الکتریکی در طول اعصاب می تواند سایر علل ضعف عضلانی حاد را رد کرده و همچنین انواع مختلف سندروم گیلن باره را تفکیک دهد. الکترومیوگرافی (Electromyography/EMG) با سوزن و همچنین مطالعات هدایت عصبی می توانند انجام شوند. این آزمایشات ممکن است در دو هفته اول هیچ گونه ناهنجاری ای را نشان ندهند. مطالعات نوروفیزیولوژی برای تشخیص الزامی نیست.
برای هر یک از زیرگروه های اصلی سندروم گیلن باره (AIDP و AMAN/AMSAN، در ادامه مشاهده کنید) معیارهایی رسمی وجود دارد، اما این معیارها ممکن است برخی از بیماران (به ویژه در مواردی که کاهش برگشت پذیر هدایت عصبی (Reversible conduction failure) وجود داشته باشد) را به اشتباه طبقه بندی کند. بنابراین تغییراتی در این معیارها پیشنهاد شده است. گاهی اوقات، تست مکرر ممکن است مفید باشد.
زیرگروه های بالینی سندروم گیلن باره
تعدادی زیرگروه برای سندروم گیلن باره شناخته شده است. با این وجود، علائم بسیاری از افراد مشابه بوده که می تواند طبقه بندی هر یک از بیماران را دشوار کند. همه انواع بیماری، شکل هایی جزئی دارند. به عنوان مثال برخی از افراد تنها مشکلات حرکتی چشم یا هماهنگی را تجربه می کنند. گمان بر این است که اینها زیرگونه ای از سندروم میلر فیشر هستند و الگوهای آنتی بادی ضد گانگلیوزیدی آنها مشابه است.
| نوع | علائم | جمعیت مبتلا | مطالعات هدایت عصبی | آنتی بادی های ضد گانگلیوزیدی |
| پلی رادیکولونورپاتی دمیلینه کننده التهابی حاد(Acute inflammatory demyelinating polyradiculoneuropathy/AIDP) | علائم حسی و ضعف عضلانی، اغلب همراه با ضعف اعصاب مغزی و درگیری سیستم عصبی خودمختار | بیشتر در اروپا و آمریکای شمالی | پلی نوروپاتی دمیلینه کننده | ارتباط مشخصی وجود ندارد. |
| نوروپاتی آکسونی حرکتی حاد (Acute motor axonal neuropathy/AMAN) | ضعف عضلانی ایزوله بدون علائم حسی در کمتر از 10 درصد موارد؛ درگیری اعصاب مغزی شایع نیست. | به ندرت در اروپا و آمریکای شمالی، بخش بزرگی (30-65 درصد) در آسیا و آمریکای مرکزی و جنوبی؛ گاهی اوقات سندروم فلج کننده چینی ها (Chinese paralysis syndrome) هم نامیده می شود. | پلی نوروپاتی آکسونی، پتانسیل عمل حسی طبیعی | GM1a/b, GD1a و GalNac-GD1a |
| نوروپاتی آکسونی حسی و حرکتی حاد (Acute motor and sensory axonal neuropathy/AMSAN) | ضعف عضلانی شدید مشابه با AMAN ولی همراه با مشکلات حسی | – | پلی نوروپاتی آکسونی، عدم وجود یا کاهش پتانسیل عمل حسی | GM1، GD1a |
| نوع حلقی-گردنی-بازویی (Pharyngeal-cervical-brachial variant) | ضعف به خصوص در عضلات گلو، صورت، گردن و شانه | – | به طور کلی طبیعی است، گاهی اوقات نوروپاتی آکسونی در بازوها | اغلب GT1a، گاهی GQ1b، به ندرت GD1a |
| سندروم میلر فیشر | آتاکسی، ضعف عضلات چشم، آرفلکسی ولی معمولاً بدون ضعف اندام | این نوع در مردان بیشتر از زنان رخ می دهد (با نسبت 2 به 1). موارد بیماری معمولاً در فصل بهار رخ داده و سن متوسط مبتلایان 43 سال است. | به طور کلی طبیعی است، گاهی اوقات تغییرات مجزایی در اچ رفلکس (H-reflex) شناسایی می شود. | GQ1b, GT1a |
سایر موارد بالینی اغلب در طیف سندروم گیلن باره قرار می گیرند. به عنوان مثال، انسفالیت ساقه مغز بیکراستاف (BBE) به همراه با یک بیماری مرتبط به نام “اختلال خواب آلودگی آتاکسیک حاد (Acute ataxic hypersomnolence)” – نوعی بیماری که در آن مشکلات تعادل و و خواب آلودگی وجود دارد اما ضعف عضلانی قابل تشخیص نیست – بخشی از گروه بیماری هایی است که امروزه به عنوان انواع سندروم میلر فیشر (سندروم آنتی بادی anti-GQ1b) در نظر گرفته می شود. BBE با شروع سریع افتالموپلژی (فلج حرکات چشم)، آتاکسی و اختلال هوشیاری مشخص می شود و ممکن است با عدم وجود یا کاهش رفلکس های تاندونی و همچنین نشانه بابینسکی (Babinski’s sign) همراه باشد. سیر بیماری معمولاً تک مرحله ای یا مونوفازیک (Monophasic) است، اما دوره های مکرر آن نیز گزارش شده است. MRI ساقه مغز در 11٪ بیماران، همراه با ناهنجاری گزارش شده است.
این که آیا از دست دادن حاد حس می تواند به عنوان نوعی از سندروم گیلن باره در نظر گرفته شود یا نه، مورد بحث و جدل است. این بیماری – که ضعف عضلانی ندارد اما با علائم حسی همراه است – نسبت به گیلن باره نادر می باشد.
درمان سندروم گیلن باره
ایمونوتراپی
ایمونوگلوبولین های درون وریدی (IVIg) و تعویض پلاسما دو درمان ایمونوتراپی اصلی برای گیلن باره هستند. تعویض پلاسما با جدا کردن آنتی بادی ها از جریان خون، حمله بدن به سیستم عصبی را کاهش می دهد. به طور مشابه، تجویز IVIg آنتی بادی های مضر و التهاب را خنثی می کند. این دو درمان به یک اندازه موثر هستند، اما ترکیبی از این دو چندان بهتر از هر دوی آنها به تنهایی نیست. تعویض پلاسما در صورتی که در طی چهار هفته پس از شروع علائم استفاده شود، سرعت بهبود را افزایش می دهد. IVIg در صورتی که در طی دو هفته پس از شروع علائم شروع شود، مانند تعویض پلاسما عمل کرده و حتی عوارض کمتری هم دارد. IVIg معمولاً به دلیل سهولت استفاده و ایمنی آن، به عنوان گزینه اول استفاده می شود. اما استفاده از آن بدون خطر نیست؛ چرا که گاهی اوقات باعث التهاب کبد یا در موارد نادر نارسایی کلیوی می شود. گلوکوکورتیکوئیدها (کورتون) به تنهایی در سرعت بخشیدن به روند بهبودی موثر نیستند و به طور بالقوه می توانند روند بهبودی را به تاخیر بیاندازند.
نارسایی تنفسی
نارسایی تنفسی ممکن است به لوله گذاری نای و حمایت تنفسی از طریق دستگاه تهویه مکانیکی، عموماً در بخش مراقبت های ویژه، نیاز داشته باشد. با انجام دو آزمایش تنفسی مبتنی بر اسپیرومتری می توان نیاز بیمار به حمایت دستگاه تهویه مکانیکی را پیش بینی کرد: ظرفیت حیاتی اجباری (Forced vital capacity/FVC) و نیروی دمی منفی (Negative inspiratory force/NIF). چنانچه FVC کمتر از 15 میلی لیتر به ازای هر کیلوگرم وزن بدن یا NIF کمتر از 60 سانتی متر آب باشد، به عنوان نشانه ای از نارسایی شدید تنفسی در نظر گرفته می شود.
درد
اگرچه درد در افراد مبتلا به سندروم گیلن باره شایع است، مطالعاتی که انواع مختلف داروهای ضد درد را مقایسه می کنند برای توصیه به اینکه کدام دارو باید استفاده شود کافی نمی باشند.
توان بخشی
پس از مرحله حاد، حدود 40٪ از بیماران برای تمرکز بر بهبود فعالیت های روزمره زندگی به یک توانبخشی فشرده با کمک یک تیم چند رشته ای نیاز دارند. اگرچه مطالعات در مورد این موضوع محدود بوده اند اما به احتمال زیاد توانبخشی فشرده علائم طولانی مدت بیماری را بهبود می دهند. تیم های مورد نیاز ممکن است شامل درمانگران فیزیکی یا فیزیوتراپیست ها، کاردرمانگران، آسیب شناسان گفتار و زبان، مددکاران اجتماعی، روانشناسان، سایر متخصصان بهداشتی و نیز پرستاران باشند. این تیم معمولاً زیر نظر متخصص مغز و اعصاب یا پزشک توانبخشی کار می کند که اهداف درمانی را هدایت می کنند.
مداخلات فیزیوتراپی شامل تمرینات قدرتی، استقامتی و راه رفتن با افزایش تدریجی تحرک، حفظ حالت بدنی و تنظیم آن و همچنین عملکرد مفصلی است. هدف کاردرمانی بهبود عملکرد روزمره در انجام وظایف خانگی و اجتماعی و همچنین رانندگی و کار کردن است. ممکن است تغییراتی در خانه داده شود یا ابزار و آلاتی برای کمک به راه رفتن، ارتوز (Orthosis) و آتل نیز ارائه گردد. آسیب شناسی گفتار و زبان ممکن است برای افرادی که در گفتار و بلع خود مشکل دارند و همچنین برای برقراری ارتباط در افرادی که نیاز به پشتیبانی تنفسی مداوم دارند (اغلب از طریق تراکئوستومی (Tracheostomy))، مورد نیاز باشد. تغذیه بیمار میتواند توسط تیم و نیز متخصصان تغذیه مورد حمایت قرار گیرد. روانشناسان می توانند امر مشاوره و پشتیبانی را برعهده بگیرند. مداخلات روانشناختی همچنین ممکن است برای اضطراب، ترس و افسردگی مورد نیاز باشد.
پیش آگهی
سندروم گیلن باره می تواند در نتیجه بسیاری از عوارض منجر به مرگ شود: عفونت های شدید، لخته شدن خون و ایست قلبی که احتمالاً به دلیل نوروپاتی سیستم عصبی خودمختار است. علی رغم مراقبت بهینه، حدود 5 درصد از بیماران می میرند.
نرخ و میزان بهبودی از فردی به فرد دیگر متفاوت است. پیش آگهی سندروم گیلن باره عمدتاً بر اساس سن (افراد بالای 40 سال ممکن است پیامدهای بدتری داشته باشند) و نیز شدت علائم پس از دو هفته، تعیین می شود. به علاوه، کسانی که قبل از شروع بیماری دچار اسهال شده اند، پیش آگهی بدتری دارند. بلوک هدایتی در مطالعه هدایت عصبی، پیش بینی کننده پیامدهای بدتری در 6 ماه آینده است. در کسانی که ایمونوگلوبولین های درون وریدی دریافت کرده اند، افزایش کمتر IgG در خون دو هفته پس از تجویز نسبت به کسانی که سطح IgG آنها به میزان قابل توجهی افزایش یافته است، با نتایج حرکتی ضعیف تری در شش ماه مرتبط می باشند. اگر بیماری بیش از چهار هفته به پیشرفت خود ادامه دهد یا نوسانات متعددی در شدت آن وجود داشته باشد (بیش از دو مورد در هشت هفته)، ممکن است پلی نوروپاتی دمیلین کننده التهابی مزمن (Chronic inflammatory demyelinating polyneuropathy) تشخیص داده شود که به طور متفاوتی هم درمان می شود.
در مطالعات پژوهشی، نتیجه یک دوره سندروم گیلن باره در مقیاس 0 تا 6 ثبت می شود. بیماری با نمره 0 کاملاً سالم است؛ در نمره 1 علائم بسیار جزئی دارد اما قادر به دویدن است؛ در نمره 2 قادر به راه رفتن است اما نمی تواند بدود؛ در نمره 3 بیمار به عصا و یا سایر وسایل حمایتی نیاز دارد؛ در نمره 4 بیمار به تخت یا صندلی خود محدود است؛ در نمره 5 نیاز به حمایت تنفسی طولانی مدت دارد و بیمار نمره 6 با مرگ مواجه می شود.
کیفیت زندگی مرتبط با سلامت پس از حمله سندروم گیلن باره می تواند به طور قابل توجهی مختل شود. حدود یک پنجم بیماران بعد از شش ماه نمی توانند بدون کمک راه بروند و بسیاری از آنها درد مزمن، خستگی و مشکل در کار، تحصیل، سرگرمی و فعالیت های اجتماعی را تجربه می کنند. HRQL در سال اول به میزان قابل توجهی بهبود می یابد.