تقديم به بيماران ان بى آى اى NBIA ايران، خانواده هاى آنها و علاقمندان به آگاهى در مورد بيمارى نادرِ دستگاه عصبى مغز، تحليل رفتگى عصبى همراه با رسوب آهن در مغز
مقدمه مترجم
به اميد كشف دارو براى درمان ان بى آى اى NBIA
تحلیل رفتگی عصبی همراه با رسوب آهن در مغز Neurodegenration with Brain Iron Accumulation
اين مقاله خلاصه اى از متن انگليسى انجمن بيمارى NBIA آمريكا (NBIA disorders association ) است. ترجمه حاضر با اجازه بنيانگزار انجمن نامبرده، خانم پاتريسيا وود Patricia Wood و از روى سايت www.NBIAdisorders.org، به زبان فارسى براى بيماران NBIA ايران و كسانى كه علاقمند به داشتن اطلاعات در مورد اين بيمارى نادرِ دستگاه عصبي مغز ميباشند، صورت گرفته است. خانم پاتريسيا وود، مادرِ دختر ٢٤ ساله مبتلا به NBIA است كه اولين انجمن بيمارى NBIA را در دنيا (امريكا) تأسيس كرده است. انگيزه تأسيس اين انجمن از جانب خانم وود با جملاتى شروع شد كه هيچ پدر و مادرى نميخواهد از دكتر بشنود: “دختر ٣ساله ات را براى مُردن به خانه ببر. براى او كارى نميتوانيم انجام دهيم”. خانم وود، نه تنها با اين جملات نااميد نشد، بلكه فعاليتهاى شغلى خود را كنار گذاشته و شروع به تلاش براى شناسايى بهتر اين بيمارى و پشتيبانى از تحقيقات پزشكى و بيماران NBIA نمود.
ما نيز به نوبه خود، اميدواريم كه بتوانيم با اين گام كوچك، پنجره اميد تازه اى براى درمانِى بهتر براى بيماران در ايران بگشاييم و با پخش اطلاعات در رسانه هاى عمومى، آگاهى بيشترى را در مورد اين بيمارى به اطلاع همگان برسانيم.
به اميد روزى كه تمامى بيماران مبتلا به بيمارى ان بى آى اى در ايران زودتر شناخته شوند و اکنون با تأسيس انجمن NBIA Iran در ايران ، اين انجمن نيز در حلقه بين المللى ان بى آى اى NBIA Alliance* ، متشكل از ده كشور، فعاليت خود را شروع كند. هدف اصلى اين انجمن پشتيبانى روحى بيماران، ايجاد نوعى همبستگى، كمك مالى براى تحقيقات پزشكى براى درك بيشتر و بهتر علت اين بيمارى و همچنين كشف دارو براى درمان ميباشد.
پزشكان متخصص مغز و اعصاب و فعال در اين زمينه، آقاى دكتر محمد روحانى و آقاى دكتر غلام على شهيدى، با همكارى تيم تحقيقاتى متخصص در بيمارستان رسول اكرم، تهران، در سال ١٣٩١ (۲۰۱۲ میلادی) براى اولين بار تشخيص بالينى و ژنتيكى ١٢بيمار NBIA را در مقاله اى علمى اعلام نمودند. اكنون تعداد بيماران شناخته شده توسط ايشان و همكارانشان به بیش از ۱۰۰ نفر ميرسد. ایران در سال ۱۳۹۹ (۲۰۲۰میلادی) رسما مرکز مستقل درمان، تشخیص، ثبت بیماران NBIA شناخته شد و بیمارستان رسول اکرم مرکز پژوهشی اختلالات NBIA با مدیریت دکتر روحانی آغاز به همکاری در مرکز تحقیقات بین المللی TIRCON نمود.
براى اطلاعات بيشتر جهت تشخيص اين بيمارى و ثبت بيماران در **TIRCON REGISTRY ميتوانيد به دو پزشك ذكر شده، مراجعه فرماييد.
لوزان – فاطمه موله حسين زاده
اختلالات ان- بی- آی- إی NBIA چیست؟
تحلیل رفتگی عصبی همراه با رسوب آهن در مغز
NBIA گروهی از اختلالات عصبی وراثتی نادر هستند که مشخصه آنها تجمع غیرعادی آهن در گره های عصبی قاعده مغز basal ganglia ميباشد. گره های عصبی مزبور مجموعه ای از ساختارهای عصبی در عمق مغز است که نقش آنها کمک به تنظیم حرکت های بدن ما است.
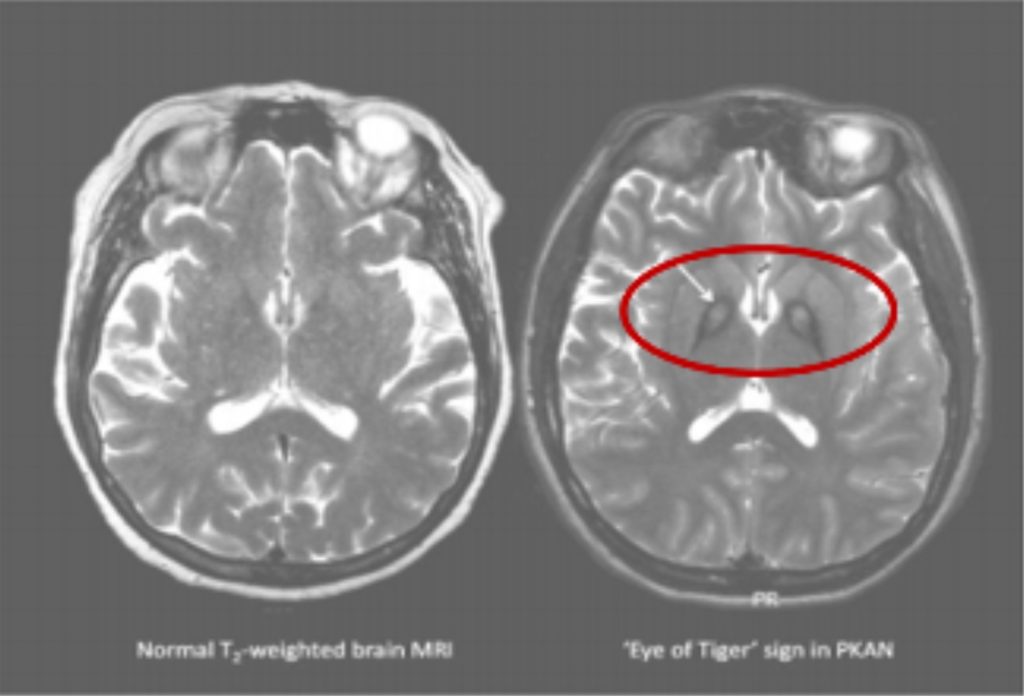
رابطه دقیق بین انباشت آهن و علائم این اختلال عصبی به طور کامل شناخته شده نیست. به طور طبیعی در این قسمت از مغز همه ما، نيز آهن وجود دارد، اما در مغز مبتلایان به این اختلال، مقدارى آهن اضافی وجود دارد که در تصویر ام- آر- آی MRI-T2 قابل مشاهده است. در بعضی از این تصاویر، آهن اضافی به صورت مناطقى تاریک در مغز دیده می شود. بیشترین مقدار آهن در قسمتی از گره های عصبی قاعده مغز دیده می شود که “گلبوس پالیدوس”globus pallidus نام دارد. این تجمع آهن اغلب در قسمت دیگری هم دیده می شود که به آن “جسم سیاه” substantia nigra می گویند.
شروع بیماری NBIA می تواند در هر زمان، از نوزادی تا بزرگسالی رخ دهد. روند پیشرفت بیماری می تواند سریع یا کند باشد که در این میان دوره های طولانی باثبات (يكنواخت) هم وجود دارد. علائم بیماری هم در افراد مختلف، تفاوت بسیارى دارد که بخشی از آن به خاطر تفاوت ژنتیکی بین خانواده ها است. همچنین تغییرات مختلف در یک ژن (از جمله جهش ژن) می تواند موجب شدت یا ضعف بیماری گردد.
عواملی که بر شدت بیماری و روند رشد آن تاثیر می گذارد، هنوز ناشناخته هستند. معمولاً افراد مبتلا به NBIA در جریان بیماری دچار ناتوانی های فزاینده می شوند.
این اختلال پیشرونده است و در حال حاضر درمانی ندارد.
تاریخچه
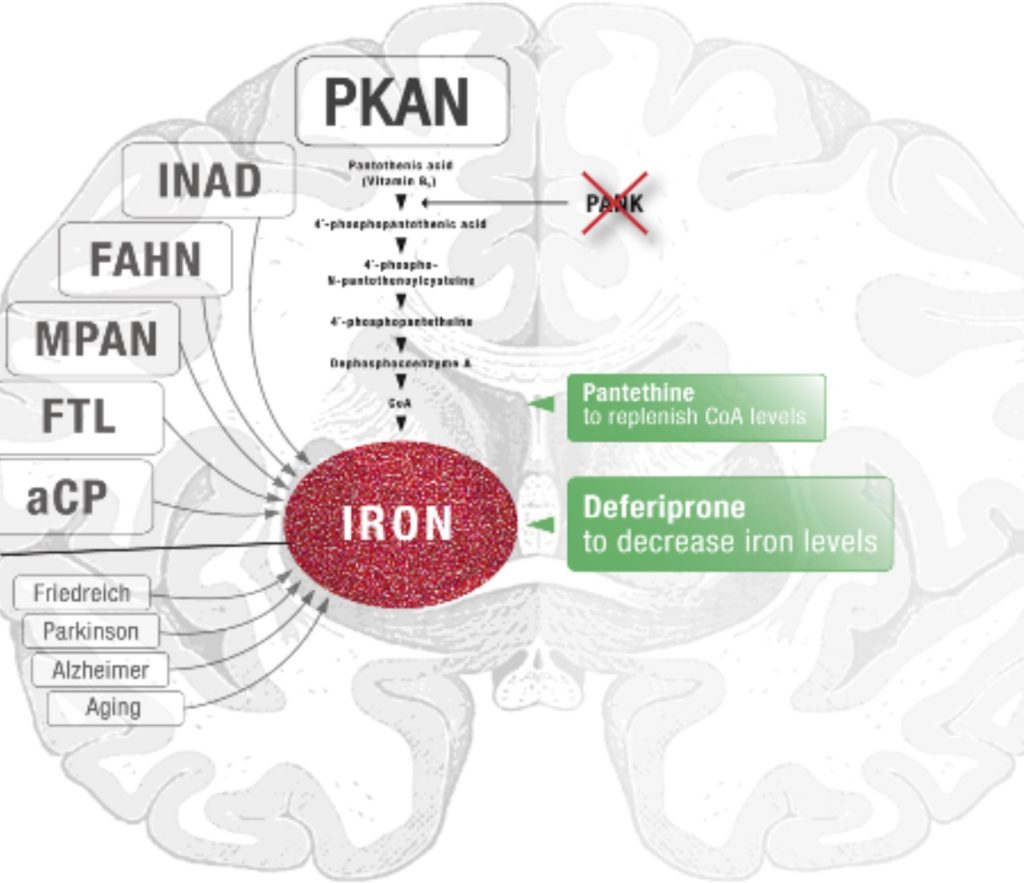
تا قبل از سال ١٣٨١ شمسی (۲۰۰۲ میلادی)، این اختلالات یا بیماری را سندرم هالرفوردن – اسپاتز Hallervorden-Spatz می نامیدند، اما بعد از آن تاريخ، پژوهشگران نام جدیدى را برگزیدند كه نه تنها بيشتر گویای ویژگی های این اختلال است، بلكه نام دو پزشک غیراخلاقی نازی را که این اختلال را شناسائی و مورد مطالعه قرار داه بودند را نیز، تداعی نمی کند. در سال١٣٨٠ (۲۰۰۱ میلادی)، اولین ژن بیماریNBIA توسط خانم دكتر سوزان هايفيليك Dr. Susan Hayflick و تيم تحقيقاتي ايشان در آمريكا کشف شد. ژن مزبور، عاملِ یک از شایع ترین اختلالات NBIA، تحلیل رفتگی عصبی مرتبط به پانتوتنت كيناز (آنزیم خاص در متابولیسم ویتامین B5) Pantothenate Kinase-Associated Neurodegeneration و به اختصار PKAN نامیده می شود.
در طول این سالها، ژن ها و اختلالات دیگر نیز در خانواده اختلالات NBIA قرار گرفته اند. در سال ١٣٨٥ (۲۰۰۶ میلادی) ژن PLA2G6 کشف و اختلال دیگری از گروه بیماری NBIA شناسائی شد که اکنون آنرابیماری تحلیل رفتگی اعصاب مرتبط به فسفولیپاز و به اختصار پلان PLA2G6-Associated Neurodegeneration، می نامند.
در سال ١٣٩٠ (۲۰۱۱ میلادی) ژن موسوم به C19orf12 در آلمان شناسائی شد که عامل نوع دیگری از این بیماری بنام تحلیل رفتگی عصبی مرتبط با پروتئین غشای(پوسته) میتوکوندريا يا به اختصار امپان MPAN
Mitchodrial-Membrane Protein-Associated Neurodegeneration است.
سال١٣٩١ (۲۰۱۲ میلادی)، اختلال دیگری بنام تحلیل رفتگی عصبی مرتبط با پروتئین بِتا پروپلر يا بیپان BPAN
Beta-propeller Protein-Associated Neurodegeneration جزو گروه اختلالات NBIA قرار گرفت. اکنون بیپان شایع ترین نوع NBIA را تشکیل میدهد.
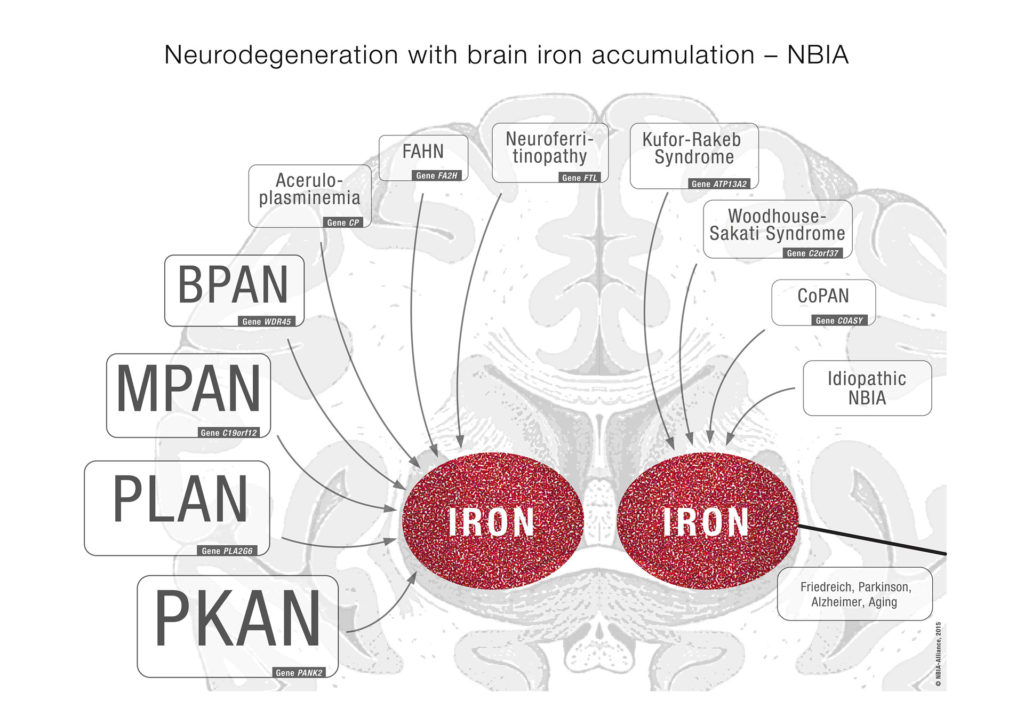
این چهارنوع از شایع ترین انواع بیماری NBIA هستند و از روی علائم متفاوت و تغییرات ژنتيكی مربوطه قابل شناسائی ميباشند. اکنون، هشت اختلال نادرتر با علائم شناخته شده ژنتيكی نيز در خانواده این بیماری قرار می گیرند که مجموع اختلالات شناخته شده NBIA را در حال حاضر به ١۲ گونه می رساند.
اختلالات NBIA، علائم و نشانگرهای جداگانه دارند ولی از نظر انباشت آهن در گره های عصبی قاعده مغز basal ganglia مشابهت دارند و مشخصه مشترک آنها اختلال پیشرونده حرکتی است. پژوهشگران انتظار دارند با کشف ژن های بیشتر، تعداد گونه های این بیماری نیز همچنان افزایش یابد.
بيماران فاقد تائیدیه ژنتیکی که علائم بالینی اختلالات آن بی آی ای را دارند، بیماران NBIA با منشاء ناشناخته يا idiopathic NBIA آن بی آی ای ناشناخته قلمداد می کنند.
برای اطلاعات بيشتر راجع به انواع اختلالات NBIA در اثر تغيير ژن های متفاوت به وب سايت www.nbiasuisse.org یا www.nbiairan.org یا www.nbiadisorders.org مراجعه نماييد.
ویژگی های این اختلالات چیست ؟
بارزترین نشانه بالینی اختلالات NBIA کاهش کارکرد عضلات و به ويژه اختلال حرکتی پیشرونده می باشد. چندين عبارت توصيفى براى علائم عصبی – عضلانی مرتبط با انواع گوناگون این اختلال به قرار زیر وجود دارد.
ديستونى يا اختلال در کشیدگی یا حالت طبیعی عضلانی (dystonia)
انقباض و گرفتگی غیرارادی عضلانى که ممکن است باعث حرکات و موقعيتهاى غیرعادی وگاهى اوقات دردناک بعضی از قسمت های بدن شود.
ديستونى يا اختلال در کشیدگی طبیعی عضلانی ممکن است عضلات دهان و گلو را درگیر کند که می تواند موجب اختلال در اداى كلمه و نارساگوئی (dysarthria) و همچنین دشواری بلع (نارسائی بلع dysphagia) گردد. پیشرفت اختلال در این عضلات می تواند منجر به از دست دادن تکلم و گازگرفتن بی اختیار زبان گردد.
نوع خاصی كه ممکن است از اختلال کشیدگی طبیعی عضلانی در رابطه با بیماری NBIA به وجود آید عبارتنداز، انقباض غیرارادی پلک blepharospasm و کج گردنی torticollis. در انقباض غیرارادی پلک، عضلات پلک ها درست عمل نمی کنند که منجر به پلک زدن های بیش از اندازه و بسته شدن غیرارادی پلک می گردد. در کج گردنی، يا انقباضات غیرارادی عضلات گردن است كه به حرکات و وضعیت های غیرعادی ماهيچه هاى سر و گردن منجر می گردد.
دائالرقص يا كره آتتوز (choreoathetosis)
اختلالی که مشخصه آن حرکات سریع و پرشی غیرارادی و نامنظم و بى هدف(موسوم به کُره) است که درارتباط با حرکت های نسبتاً کند و پیچشی رخ می دهد مثل حركات نوشتن (athetosis).
اسپاسم spasms
به علت مقاومت مداوم در برابر آرامش عضلانى و افزون بر آن انقباض غیرعادی عضلات (سفتى ماهيچه)، بيمار ممكن است احساس سفتى در دست و پا نماید. اسپاسم و سخت شدگی عضلانى معمولا از پاها شروع می شود و در مرحله بعد به دست ها سرایت می کند.
پارکینسونسيم Parkinsonism
وضعیتی که نشانه آن عبارت از لرزش، کندی حرکات، سفت شدگی عضلات و ضعف تعادل است. با بالارفتن سن، ممکن است افراد مبتلا نهایتاً کنترل حرکات ارادی را از دست بدهند. اسپاسم عضلانی همراه با کاهش جرم استخوان ممکن است بدون وجود ضربه یا حادثه ای موجب شکستگی استخوان گردد.
اختلالات بينايى و ساير عوارض در دستگاه عصبی
اين اختلالات و عوارض در مورد اغلب بيماران NBIA وجود دارد. شایع ترین مشکلات عبارتنداز:
• تحلیل رفتگی شبکیه retina degeneration
• تحليل عصب بینائی optic atrophy
• اُفت عمومی سلول ها و بافت مغز یا کاهش حجم مغز و مخچه cerebral atrophy and cerebellar atrophy از جمله
• كاهش شناخت cognitive decline
تحليل رفتگى شبكيه يا Retina degeneration
پرده شبکیه retina غشای نازکی است که قسمت عقب کره چشم را می پوشاند. کار این پرده ادراک تصاویر و ارسال آنها به مغز است. در مبتلایان به NBIA، نشانه های اولیه تحلیل رفتگی پرده شبکیه ممکن است ضعف بینائی در شب و محدودشدن میدان دید (اصطلاحاً پدیده دید کانونی) باشد که نهایتاً می تواند موجب افت قابل ملاحظه بینائی گردد.
تحلیل رفتگی یا آتروفی عصب بینائي optic atrophy
موجب تخریب عصب بینائی می گردد که کارآئی آن ارسال پیام ها از پرده شبکیه به مغز است. عصب بینائی همچون کابلی است که از هزاران رشته سیم نازک الكتريكى تشکیل شده که هر یک مقداری از اطلاعات بینائی را به مغز منتقل می کند. هنگامی که این عصب دچار آسیب دیدگی یا پارگی می گردد، دید شخص تار می گردد، دید جانبی یا رنگی ممکن است غیرعادی گردد، مردمک درست کار نکند یا میزان روشنائی در یک چشم در مقایسه با چشم دیگر کاهش یابد. آتروفی عصب بینائی ممکن است در نهایت موجب نابینائی گردد.
اُفت عمومی سلول ها و بافت مغز cerebral atrophy and cerebellar atrophy
باعث تحلیل رفتگی مخ و مخچه ميشود و در این بیماری نيز، غالباً مشاهده میگردد.
با آنكه عمدتاً بيمارى NBIA تاخیر در رشد و به ويژه در ارتباط با مهارت های حرکتی را شامل می گردد، در برخی از بيماران، اختلال کاهش شناخت cognitive decline نيز، رخ می دهد، در اغلب موارد تفکر، ادراک و دیگر فرایندهای ذهنی نسبتاً مصون می مانند. با وجود اين، ممکن است اختلال حرکتی، مانع انجام آزمون سنجش عقل گردد. لذا تهیه روش های جدیدتر بررسی هوش برای تعیین میزان درگیری جنبه های شناختی ضرورى است.
در سلول های عصبی مبتلایان به NBIA یافته مشترکی وجود دارد که تنها با بررسی بافت عصبی حاصل از نمونه برداری در ميكروسكوپ الکترونیكى قابل ردیابی است. سلول های عصبی دارای زائده های بلندی بنام آکسون هستند که پیام ها را از سلولی به سلول دیگر انتقال میدهند. در سلول های عصبی این بیماران، ضایعاتی روی بعضی از آکسون ها تجمع می کنند كه موجب متورم شدن آنها، همراه با مجموعه اى از بقايا و زائرات سلولى ميشود كه نبايد آنجا باشند. این تورم ها را اجسام کروی آکسون می نامند. این اجسام کُروى در بیشتر بیماران ان بی آی ای، تنها روی عصب های مغز و رشته نخاعی قرار دارند. بنابراین تا زمانی که یک بیمار فوت شده، کالبدشکافی نشود، این اجسام کروی قابل ردیابی نیستند. اما در كودكان مبتلا به آی ندINAD يا تحلیل رفتگی آکسون های سلول های عصبی كودكان، این اجسام کروی در اعصاب سرتاسر بدن آنها یافت می شود و برای جستجوی آنها میتوان از پوست، عضله یا سایر بافت ها نمونه برداری کرد. در معدودی از بيماران امپان MPAN نيز اجسام کُروی در اعصاب محیطی، یافت شده است.
جنبه های ژنتیکی
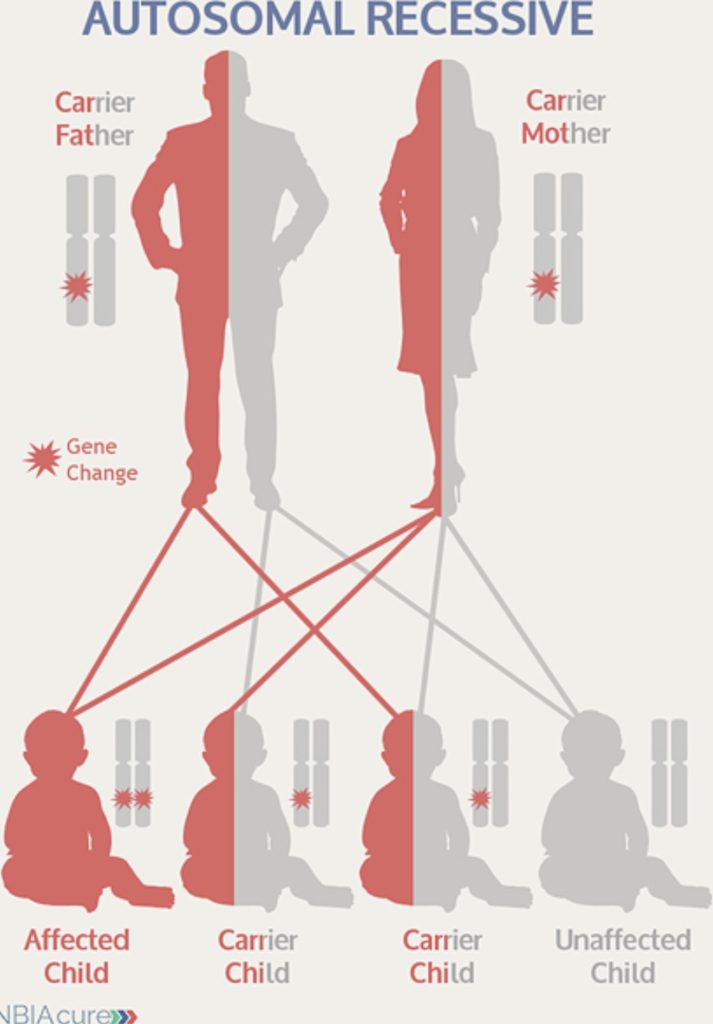
از میان ١٠ گونه بیماری NBIA که در حال حاضر از نظر ژنتيكى شناخته شده اند به غیر از دوگونه که از نظر ژنتیکی غالب هستند، بقیه از طریق ژن مغلوب به نسل بعدی منتقل می شود. از آنجائیکه بیشتر ژن های ما به صورت جفت وجود دارند (یکی از پدر و یکی از مادر)، لذا ما به طور معمول ناقل دونسخه سالم (قابل استفاده) از هر ژن هستیم. هنگامی که یک نسخه از یک ژن نهفته دچار تغییر (جهش ژنتیکی mutation) میشود، فرد مزبور همچنان از سلامت برخوردار است. چنین فردی را ناقل می نامند.
بیماری ژنتیکی مغلوب یا نهفته
ژن های جهش یافته در بیماری های نهفته یا مغلوب، تنها زمانی بروز می کنند که والدین سالم هر دو ناقل نقص مشابهی ای باشند و سپس ژن های تغییریافته را به فرزندان خود منتقل کنند. به لحاظ آماری، احتمال اینکه دو ناقل صاحب فرزند مبتلا شوند یک از چهار در هر بارداری است. احتمال اینکه فرزند چنین والدینی نیز ناقل باشد، دو از چهار در هر بارداری و احتمال اینکه جهش ژنتیکی به فرزند آنها منتقل نشود، یک از چهار در هر بارداری است.
نمودار يا شجره نامه در تصویر پایین تر نشان می دهد که چگونه اعضای مختلف يك خانواده به یکدیگر مربوط هستند و چه شرایط پزشکی در خانواده تشخیص داده شده است. در نمودار يا شجره نامه زير نماد مربع برای نشان دادن مرد و دایره برای زنان استفاده شده است.
نمودار يا شجره نامه يك خانواده حامل يك بيمارى ژنتيكى از نوع نهفته
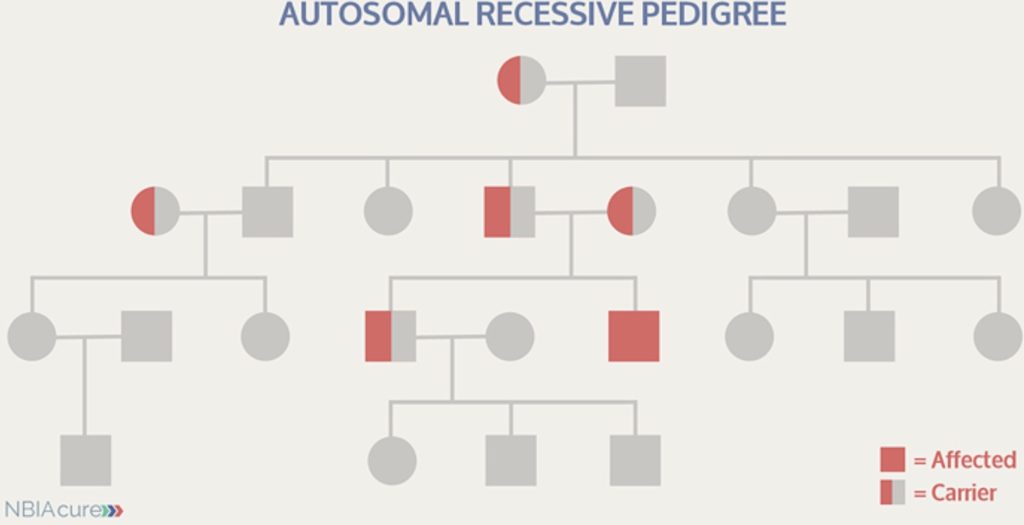
خطوط عمودی فرزندان یک زن و شوهر را نشان ميدهد. هر نسل جديد زیر نسل پدر و مادر خود قرار دارد.
قدیمی ترین افراد در بالای صفحه می باشند افراد مبتلا به بيمارى ژنتيكى را به حالت پرشده، در حالی که کسانی که حامل این بیماری هستند فقط نيمه پرشده نشان داده شده اند.
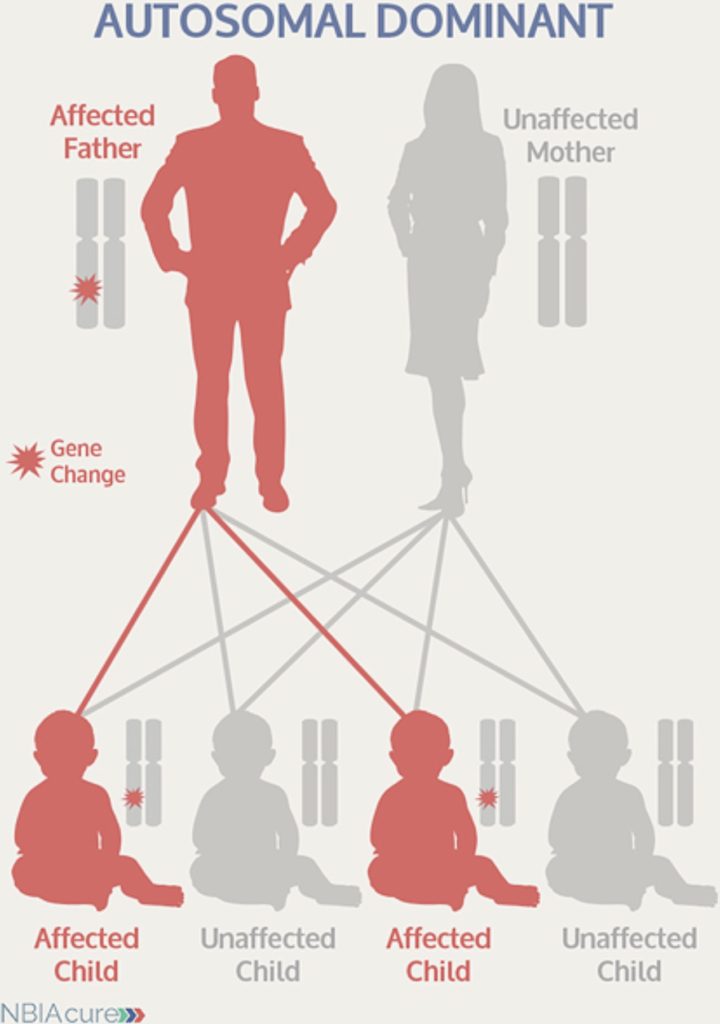
بیماری ژنتیکی غالب
بیماری نویرو فریتینوپاتی یا اختلال عصبی مرتبط به مشکل در پروتئین فریتین نویرون (کنترل کننده آهن) (Neuroferritinopathy) که موجب انباشت غیرعادی آهن در بافت عصبی می گردد، از نوع اختلال ژنتیکی غالب است. فرد مبتلا به این اختلال دارای یک نسخه سالم از ژن و یک نسخه جهش یافته از همان ژن است. همین یک نسخه از ژن جهش يافته کافی است تا موجب بیماری گردد. پنجاه درصد احتمال وجود دارد که یک فرد مبتلا، تغییر ژن را به هر یک از فرزندان خود منتقل کند. در بیشتر مبتلایان، یکی از والدین مبتلا به بیماری است.
نمودار يا شجره نامه يك خانواده حامل يك بيمارى ژنتيكى از نوع غالب
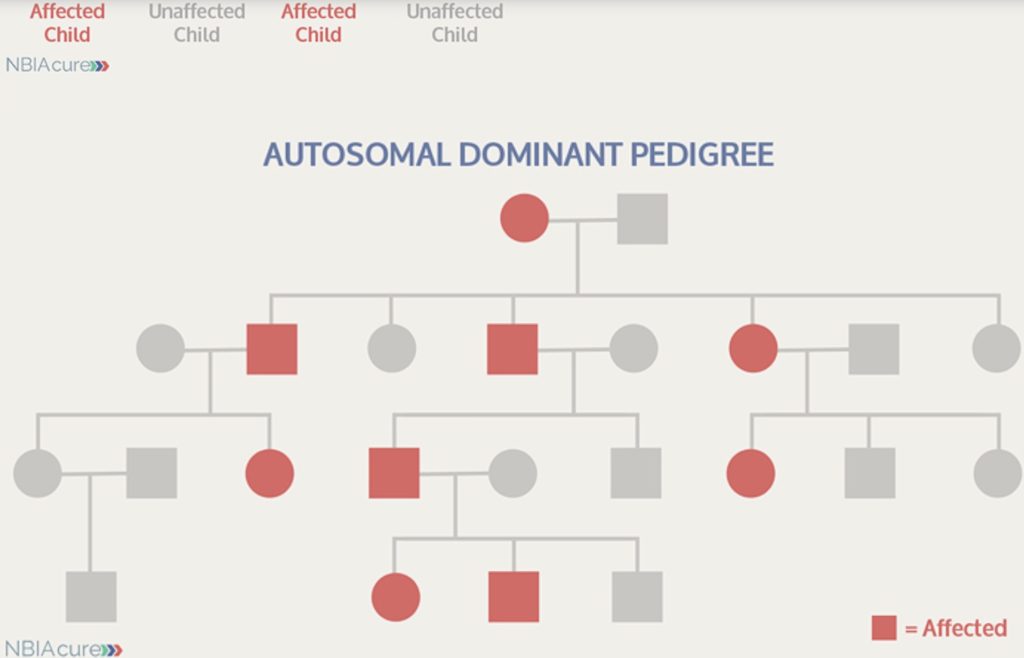
تصور می شود که بيمارى بیپان یا تحلیل اعصاب مرتبط با پروتئین بتاپروپلر BPAN اکثراً به صورت نوظهور بروز می کند، به این معنا که تغییرات در ژنی رخ ميدهد که در فرد مبتلا نوظهور بوده و از هیچ یک از والدین به ارث نرسیده است. این تغییر ممکن است در سلول جنسی (تخمک یا اسپرم) از یکی از والدین یا در خود تخمک لقاح یافته، پدید آید. در مورد بیپان، ژن تغييريافته روی کرموزوم ایکس X ، یعنی یکی از جفت کروموزومی که جنسیت نوزاد را تعیین می کند، واقع شده است.
جمعیت در معرض ابتلاء
بطور کلی تعداد مبتلایان مرد و زن برابر است به استثناء بیپان BPAN كه در زنان بیشتر رخ ميدهد. احتمال ابتلا به بیماری NBIA یک الى سه نفر در هر یک میلیون برآورد می شود. از آنجائیکه اختلالات نادری مانند NBIA اغلب ناشناخته می مانند يا فاقد تشخيص كاملند و دچار تشخیص نادرست می شوند. تعیین صحت این آمار دشوار ميباشد.
درمان
در حال حاضر درمان استانداری برای NBIA وجود ندارد و درمان بیماری با توجه به علائم خاصی که در هر فرد بروز می کند، صورت ميگرد. پژوهش های حاضر، درک بهتر عوامل اصلى بیماری را در کانون توجه خود قرار داده اند، که می تواند سرانجام به درمان جامع تری دست یابد.
درمان این بیماری مستلزم تلاش های هماهنگ شده ی تیمی از متخصصان است. پزشکانی که خانواده بیمار می تواند با آنان مشورت کند، شامل متخصص کودکان یا داخلی، متخصص اعصاب، متخصص بیماری های ریوی، چشم پزشک، متخصص استخوان یا ارتوپد، فوق تخصص گوارش و متخصص ژنتیک بالینی. رویکرد تیمی، جهت درمان حمايتى، شامل فیزیوتراپی، فیزیولوژی ورزشی، کاردرمانی و گفتاردرمانی نیز میباشند. افزون بر آن بسیاری از خانواده ها می توانند از مشاوره ژنتیکی نیز بهرهمند شوند.
با پیشرفت بیماری معمولا لازم است در داروها و سایر درمان ها تعدیلاتی صورت گیرد. برای دستیابی به بهترین ترکیب، ممکن است چندین ترکیب مورد آزمایش قرار گیرد.
مديريت درد
مديريت درد براى بيماران NBIA ميتواند بسيار مشكل باشد. به نسبت پيشرفت بيمارى، خيلي از بيماران ميتوانند دوران كشيدگى غير طبيعى عضلانی شديد كه روزها يا هفته ها طول ميكشد، را تجربه كنند. بخصوص در حين اين دوران بسيار مهم است علت درد كه شامل، خونريزى مخفى GI، عفونت دستگاه ادرارى و شكستگى نهفته استخوان ميباشند، بررسى شود. تركيبى از استوپنيا osteopenia (مرحله قبل از استخوان پوكى) در شخص بى حركت و فشار بسيار زياد روى استخوانهاى بلند بدليل كشيدگی غير طبيعی عضلانی، افراد مبتلا به NBIA را در معرض ريسك بزرگ براى شكستگى استخوان، بدون علت آشكار يا حادثه اى، قرار ميدهد.
در حاليكه داروهاى قوى براى تسكين درد ممكن است اثرات ديگر يا عوارض جانبى داشته باشند،با اين وجود اين عوارض ميتوانند با مديريت فعال و ممتد يك دكتر، كاهش يافته و لذا این داروها براى بيماران NBIA جهت مقابله با درد لازم است.
ساير محرك ها یا دلایل كه باعث كشيدگى غير طبيعى عضلانی ميشوند، ميتوانند فشار روحى، خود بيمارى و بلوغ باشند.
به علاوه در مواردی که درمان مشخصی برای علت زمینه ای درد وجود ندارد، عموماً رویکردهای استاندارد کنترل درد توصیه میشود.
مديريت دردِ كشيدگی غير طبيعى عضلانى
كشيدگى غير طبيعى عضلانى يا ديستونى dystonia حركات غير ارادى و انقباض طولانى مدت ماهيچهها هستند كه به حركت چرخشى بدن، لرزش و وضعيت غيرعادى تبديل ميشود. اين حركات ميتواند تمام بدن يا يك محوطه تنها را، درگير نمايد.
طوفانِ كشيدگى غير طبيعى عضلانى يا دیستونی شدید dystonia storm، حركات شديد و كشيدگى مداوم غير طبيعى عضلانى به علت وخيم شدن ديستونى موجود و يا شروع شدن دوباره آن است، كه ميتواند ساعتها الى روزها ادامه داشته باشد و مشكل شديد روحى و جسمى براى بيمار ايجاد كند.
درمانهاى موجود عبارتنداز:
• باكلوفن خوراكى يا از طريق تزريق در مايع داخل نخاعى
• تركيبات خوراكى آنتیكولينرژيك anticholinergic، نظير تريهگزيفنيديل يا آرتان
• كربيدوپا و لِوودوپا Carbidopa/Levodopa
• بنزوديازپین ها benzodiazepines نظير كلونازپام، لورازپام و ديازپام
• تزريق بوتولونيوم توكسين (بوتاكسBotox ) در ماهيچه
• جراحى تحريك عمقی مغز(DBS) – كه جايگزين پاليدوتومى و تالاتومى، كه در گذشته صورت ميگرفته، شده است.
• داروى كاهش دهنده سطح اهـن بدن، چنگك آهن يا جذب كننده آهن iron chelating agent كه پس از مطالعه بالينى اخیر، اکنون پزشکان میتوانند به برخی از بیماران اختلالات عصبی مربوط به تجمع آهن توصیه نمایند.
• داروهاى ضد تشنج نظير كاربامازپين و گاباپنتين
• مكمل هاى فيبردار بدون نسخه
• استفاده از وسایل کمکی
باكلوفن Baclofen
یکی از سازگارترین درمانهاى دارويى براى اختلال كشيدگى غير طبيعى عضلانی است. این دارو را نخست به صورت خوراکی مصرف می کنند. همچنین میتوان از یک پمپ حاوی این دارواستفاده نمود که مقدار ثابتی از دارو را به صورت خودکار داخل مایع نخاعی می ریزد. این پمپ برای افراد مبتلا به بیماری NBIA یک گزینه است، که میتوان احتمال پاسخ مثبت بیمار را به استفاده از آن مورد ارزیابی قرار داد.
براى اطلاعات بيشتر لطفا به ضميمه مراجعه فرماييد.
آنتیكولينرجيك anticholinergic
داروی متوقف کننده موج تحریکات عصبی، موسوم به تريهگزیفنیدیل (در بعضی کشورها با نام تجاری Artane) دومین داروئی است که بیمار میتواند به تنهائی یا همراه با baclofen مصرف کند. در مورد بسیاری از افراد مبتلا به پکان PKAN ترکیب baclofen و Artane مفید واقع شده است.
Carbidopa/Levodopa با نام تجاری Sinemet
مصرف اين دارو در مورد بعضی از بیماران مبتلا به نوعِ ناشناخته ان بی آی ای يا idiopathic NBIA، موثر بوده است. هرچند به نظر نمی رسد در مورد بیماران مبتلا به پکان PKAN تاثیری داشته باشد.
بنزودیازپین ها Benzodiazepines مانند دیازپام Diazepam
در بعضی از کشورها با نام تجاری والیوم Valium و لورازپام Lorazepam (در بعضی کشورها با نام تجاری Ativan)، سایر داروهای شل کننده ميباشند. اثربخشی و تحمل پذیری این داروها در هر بیمار فرق میکند.
بوتاكس Botox يا بوتولونيوم توكسين Botulinum toxin
تزريق عضلانى اين دارو برای بيمارانى که دچار اختلال عصبى عضلانی شده اند به کار می رود و هر بار میتواند به مدت چند ماه موجب تسکین گردد. تزریق این ماده موجب ضعف موقت عضلانی می گردد که دچار انقباضات غیرارادی منجر به درد، پیچ خوردگی و قرار گرفتن در وضعیت غیرعادی شده اند و نیز سبب تغییر در صدا یا گفتار فرد میشود. از آنجایی که در هر عضله درگیر باید جداگانه تزریق شود، این روش هنگامی عملی تر است که بخش خاصی از بدن بيمار مانند دست یا فک دچار اختلال عصبی عضلانی قابل ملاحظهای شده باشد. براى اطلاعات بيشتر به بخش ضميمه، اطلاعات پزشكی بوتاكس Botox مراجعه شود.
Deep Brain Stimulation اختصاراً DBS
روش درمانی دیگری است که از طریق تحریک عمقی مغز برای کنترل ضعف عضلانی به کار میرود. این روش با قراردادن الکترودهایی در مغز و یک وسیله قابل برنامهریزی تحریک کننده عصب يا نويروستيمولاتور neurosimulator در زیر پوست سینه یا شکم انجام میشود. تحریک کننده عصبی، ضربان های الکتریکی (پالس) را به مناطق موردنظر در مغز میفرستد و به این ترتیب الگوهای غیرعادی فعالیت گرههای عصبی قاعده مغز را که موجب حرکات دردناک میگردد، تغییر میدهد. این روش بر روی چندین مورد بیماری NBIA نتایج خوبی به همراه داشته است. هر چند سودمندی این روش در بلندمدت روشن نیست.
برای اطلاعات بيشتر به بخش ضميمه، اطلاعات پزشكى DBS اين بروشور مراجعه شود.
چنگك آهن iron chelating agent يا جذب كننده آهن
در حقیقت داروهای کاهش دهنده سطح آهن بدن هستند که اثربخشی آنها در درمان NBIA تحت مطالعه و بررسی قرار گرفته است. برخی مطالعات نشان داده است که داروی موسوم به دفريپرون Deferiprone در مورد بعضی از مبتلایان به NBIA موثر بوده است. پس از مطالعات بالینی جامع تر، اثربخشی این دارو روی بیماران پکان PKAN، ارزیابی مثبت داشته و اکنون در اختلالات NBIA و سایر اختلالات تحلیل اعصاب مربوط به تجمع آهن در مغز توصیه می شود.
براى اطلاعات بيشتر به بخش ضميمه، اطلاعات پزشكى ( داروی دفريپرون) مراجعه فرماييد.
داروهاى ضد تشنج
افرادی که دچار حمله ( تشنج) میشوند معمولاً از داروهای ضدتشنج استاندارد استفاده میکنند.
مكمل هاى فيبردار بدون نسخه
بسیاری از مبتلایان به NBIA به خاطر کاهش فعالیت، رژیم غذائی و/ يا عوارض جانبی دارو درمانی پیوسته، دچار یبوست هستند. مصرف مکمل هاى فیبردار بدون نسخه و نرم کننده مدفوع از ناراحتی این افراد میکاهد.
استفاده از وسائل كمكى
استفاده از وسائل كمكى مانند ویلچر و ابزارهائی که به گفتار فرد کمک می کند ضرورت می یابد.
أشكال شناخته شده ان بى آى اى NBIA
تحليل اعصاب همراه با رسوب آهن در مغز NBIA
پکان PKAN يا Pantothenic Kinase-Associated Neurodegeneration
تحليل عصبى در اثر جهشهای پیش آمده در ژن موسوم به PANK2 ایجاد میشود. این یکی از شایع ترين بيماری از مجموعه اختلالات ان بی آی ای است که اکنون 35 درصد از مبتلایان را تشکیل میدهد. نقش این ژن تهیه دستورالعمل تولید آنزیمی به نام pantothenate kinase است. درحال حاضر پژوهشگران در حال بررسی این موضوع هستند که چگونه فقدان این آنزیم موجب آسیب دیدگی سلولهای عصبی در مغز و انباشت آهن مشخصه در آنها میشود.
بیماری پکان PKAN را عموماً به دو گونه پکان کلاسیک و پکان غیرمعمول atypical دستهبندی میکنند، گرچه افرادی هستند که ویژگیهای بیماری آنان به گونه ای است که بین این دو دسته قرار میگیرند. پیشرفت علائم در افراد مبتلا به بیماری نوع کلاسیک سریع تر است. در بیشتر موارد پیشرفت بیماری در نوع غیرمعمول کندتر بوده و طی چندین سال و بعضاً چند دهه صورت میگیرد. علائم و یافته های فیزیکی در مورد هر فرد متفاوت است.
مشخصه های بیماری در برخی افراد آنها را بین این دو دسته قرار می دهد. چون علائم بنا بر این دو فرم متفاوت هستند، بنابراین طیف گسترده ای از علائم در آنها مشاهده می شود.
پکان کلاسیک
کودکان مبتلا به پکان کلاسیک معمولا در حدود سه سالگی دچار مشکلاتی در راه رفتن میشوند و سپس به صورت پیشرونده دچار اختلالات عصبى عضلانی، نارسایی در گویش، سفت شدگی عضلات، اسپاسم عضلانی، رفلکس مفرط و گرفتگی پنجه پا میشوند.
پکان غیر معمول
در اغلب موارد، پیشرفت علائم آهسته است که در طی چندین سال، حتی چندین دهه نمایان میشود، دیرتر و ملایمتر از پکان کلاسیک است.
پکان غیر معمول در بیشتر اوقات پس از 10 سالگی و در سه دهه اول زندگی رخ می دهد. میانگین سن پدیدار شدن علائم در 13 سالگی است. علائم مورد تا مورد فرق دارند و متنوع تر از نوع زودرس بیماری می باشند. ناتوانی در راه رفتن به طور معمول 15 الی 40 سال پس از پیدایش علائم رخ میدهد. افرادی که علائم بیماری پکان دیرتر در آنها بروز میکند، مشکل تکلم پیدا میکنند. در مواردی که بیماری در سنین بالاتر عارض میشود بروز علائم روانی شیوع بیشتری دارد. تحلیل رفتگی پرده شبکیه به ویژه در نوع کلاسیک شایعتر است.
پلان PLAN يا PLA2G-Associated Neurodegeneration
تحلیل عصبی مربوط به ژن PLA2G6، پلان نام دارد. این گروه شامل ديستروفى آكسونی عصبی نوزادان یا آی ند
Infantile Neuroaxonal Dystrophy = INAD و ديستروفى آكسونى عصبى آتيپيك یا ند NAD و سندروم ديستونی پارکینسونسيم دیستونی-پارکینسونیسم مرتبط با PLA2G6 بزرگسالان می باشد.
آی ند INAD
اولین نشانه های نوع کلاسیک زود بروز میکند و پیشرفت آن سریع است. نشانهها و علائم بیماری معمولاً بین 6 ماهگی الی 3 سالگی در فرد مبتلا ظاهر میشود. اولین نشانهها تأخیر در رشد و در مهارت هایی مانند راه رفتن و حرف زدن است. این کودکان ممکن است خيلى زود شلى عضلانى يا hypotonia داشته باشند که بعداً به میزانی که بزرگتر میشوند به گرفتگی عضلانی يا spasticity به ویژه در دست و پا منجر می شود. بیماری چشم ناشی از تحلیل رفتگی عصب بینایی در این کودکان شایع است و میتواند موجب ضعف بینایی و نهایتاً نابینایی گردد.
این اختلال اکنون از سن شش ماهگی الی اوایل دوران کودکی تشخیص داده می شود.
ند NAD (يا آی ند غیر معمول (AINAD
معمولاً دیرتر از آی ند و معمولا در اوایل دوران کودکی شروع میشود، اگر چه اين نوع بيماری ممکن است در دهه دوم زندگى نيز ظاهر شود. آهنگ رشد آن کندتر است و مشکلات حرکتی آن نیز با آی ند تفاوت دارد. در آغاز ممکن است کودک تأخیر در حرف زدن یا ویژگیهای شبیه اوتیسم داشته باشد. در نهایت مشکلات حرکتی ظاهر میشود. برخلاف آی ند كلاسيك، بيماران ند معمولا اختلال عصبی عضلانى دارند. این افراد همچنین دچار تغییرات رفتاری، نظیر رفتار تکانشی (رفتار تند)، عدم توانایی توجه بر یک موضوع برای مدت طولانی یا افسردگی میگردند که نیازمند درمان توسط پزشک است.
دیستونی-پارکینسونیسم مرتبط با PLA2G6
آغاز علائم این اختلال در سنین متفاوت از کودکی تا دهه دوم و سوم زندگی است. بیشتر این افراد در اوایل بزرگسالی اختلال در راه رفتن یا تحولات روانی عصبی دارند.
در اواخر نوجوانی تا اوایل دهه بیست زندگی، بیماران دیستونی را تجربه می کنند که بیشتر در دست و پا مشاهده می شود اما ممکن است همگانی نیز باشد، سای علائم شامل این موارد است: اختلالات حرکت چشم و پارکینسونیسم، کندی (برادیکینزیا) ، بی ثباتی تعادل (کاهش تعادل)، لرزش در حالت استراحت، سفتی که ممکن است همراه با کاهش سریع شناختی باشد.
امپان MPAN يا Mitochondria-Membrane Protein-Associated Neurodegeneration
تحلیل عصبی مرتبط با پروتئین غشای (پوسته) ميتوكوندريا است که مسبب آن تغییر یا جهش ژن غیرجنسی موسوم به C19orf12. الگوی وراثتی آن اکثرا نهفته یا مغلوب و در موارد بسیار نادر غالب است.
جهش های C19ORF12 نیز در دو بیماری دیگر SP43 و Syndrome Behr (Rita Horvarth et.al. 2020 و Landoure et.al) گزارش شده اند. حدس زده مى شود که این ژن نقشى در متابولیسم اسیدهاى چرب دارد.
امپان یکی از اشكال قابل توجه NBIA است و علائم بالینی آن از سایر انواع آن متمایز است. این بيمارى از دوران کودکی تا اوايل بزرگسالى با تغییر راه رفتن در فرد، مشخص و شروع می شود و سپس با اسپاستیک پيشرونده ( عضله زيادى منقبض شده) اختلال در كشيدگى طبيعى عضلانى (ديستونى) به همراه واكنش زيادى تاندون، واكنشهاى عصبی و روانی غير طبيعى و در اکثر افراد مبتلا به امپان همراه با کاهش شناختی ميباشد.
این اختلال در حال حاضر با پدیدار شدن علایم از سنین شش سالگی الی بزرگسالی تشخیص داده می شود.
بیپان BPAN يا Beta-propeller Protein-Associated Neurodegenration
تحلیل عصبی مرتبط با پروتيين بتا پروپلر در اثر جهشهایی در ژن WDR45 واقع بر روی کروموزوم X ( کروموزوم جنسی X) پدید میآید. اکنون بیپان شایع ترین نوع NBIA را تشکیل می دهد. تا به امروز کلیه افراد مبتلا به این نوع از بیماری که گزارش شده اند مواردی هستند که اصطلاحاً به آن “تک” می گویند (یعنی بروز یک مورد “تک” در یک خانواده). اکثریت آنان زن هستند که حکایت از آن دارد که جهشها نوظهور ميباشند و نیز بر این امر دلالت دارد که در اکثر مردان جهش های مزبور مهلک هستند. افراد مبتلا به این نوع در کودکی دارای تأخیر رشد کلی همراه با کندی رشد حرکتی و شناختی هستند. این افراد در دوران نوجوانی یا بزرگسالی دچار بروز نسبتاً ناگهانی اختلال عصبى عضلانی، پارکیسونيسم و زوال عقل پیش رونده میگردند.
این اختلال اکنون از شش ماهگی الی بزرگسالی تشخیص داده می شود.
فهن FAHN يا Fatty Acid Hydroxylase-Associated Neurodegeneration
نوع دیگر تحلیل رفتگی عصبی مرتبط با آنزیم اسیدهای چرب هیدروکسیلاز است که در اثر جهش در ژن FA2H پدید میآید. در حال حاضر، تنها معدودی خانواده با این شکل نادر از بیماری شناسایی شده اند. با این حال ، دو بیماری عصبی دیگر ، لويکودیستروفی و اسپاستیک پاراپلژیا ارثی ٣٥ (HSP35) كه قبلاً به عنوان اختلالات جداگانه ای تصور می شدند، اکنون در طیف FAHN گنجانده شده اند.
شروع بیماری در دوران کودکی با مشخصه اختلال عصبى عضلانی در پا، ضعف عمومی و زمین خوردن شروع میشود. افراد مبتلا همچنین دچار آتروفی (باريكتر شدن) عصب بینایی، آتروفی عمقی مغزو تغییراتی در ماده سفيد مغز به علاوه تجمع آهن در مغز میگردند.
کوپان CoPAN يا COASY یا Protein-Associated Neurodegeneration
تحليل اعصاب مرتبط با پروتئین COASY كه در اثر جهش در ژن COASY ایجاد می شود، در سال ۱۳۹۲ شمسی (2013 میلادی) كشف شد. اين ژن حاوى كُد پروتئینی به نام Coenzyme-A Synthase است. این اختلال نیز يك نوع NBIA است همراه با گرفتگى يااسپاسم spaticity و ضعف اندام تحتانی در اوایل بیماری و انباشت آهن و كلسيم (کلسیفیکاسیون) در گلبوس پاليدوس .Globus pallidus این اختلال در دوران كودكى شروع ميشود. تنها چند مورد از بيماران کوپان گزارش شده است. اطلاعات در مورد کوپان با شناسايى افراد مبتلا به آن، ممکن است تغییر يابد.
نوروفریتینوپاتی NEUROFERRITINOPATHY
این بیماری یک فرم غالب ژنتیکی NBIA ناشی از جهش در ژن FTL است. ژنی که زیر واحد سبك پروتئین فریتین را (كه از دو واحد بروتين سبك و سنگين تشكيل شده) کدگذاری میکند. فریتین مسئول ذخیره آهن و آزاد سازی آن در سلول های بدن است. نوروفریتینوپاتی نوعی از اختلالات NBIA است که با علائمی شبیه بیماری هانتینگتون همراه با کوریا یا دیستونی بزرگسالان و تغییرات شناختی (ذهنی) مشخص می شود.
مشکلات حرکتی به طور معمول در ابتدا یک عضو يا دو عضو بدن (دست، پا) را تحت تأثیر قرار می دهد ، سرانجام در عرض 5 الی10 سال به تمام اندام ها پیشرفت می کند و در عرض 20 سال می تواند كل بدن را درگير نمايد. با گذشت زمان ، کاهش زوال ذهنی و مسائل رفتاری و روانی برای افراد مبتلا به نوروفریتینوپاتی به مشکلات مهمی تبدیل می شود.
طول عمر متوسط در افراد مبتلا به نوروفریتینوپاتی متفاوت است ، اما به دلیل پیشرفت در مراقبت های پزشکی، بیشتر افراد مبتلا به این بیماری تا اواخر بزرگسالی به خوبی زندگی می کنند.
شیوع این بیماری ناشناخته است. حدود 100 مورد گزارش شده است. بیشتر این افراد دارای تغییر ژن یکسانی هستند که نشان می دهد اجداد (جد) مشترکی داشته اند.
کوفر راکب Kufor-Rakeb
این اختلال بسیار نادر NBIA شناخته شده با نام پاركينسون 9 ، اولین بار در سال ۱۳۷۴ شمسی (سال 1994میلادی) در دهکده ای در اردن به نام Kufor-Rakeb توصيف و بر اساس نام آن دهكده نامگذاری شده است. ژن تغییر یافته مسئول اين اختلال ATP13A2 که PARK9 نیز نامیده می شود و در سال 2006 شناسایی شد. اكنون تعداد کمی از خانواده هـاى مبتلا به اين اختلال در ایالات متحده ، ایتالیا ، آمریکای جنوبی ، خاورمیانه و آسیا تشخیص داده شده اند.
این بیماری با پارکینسونیسم نوجوانان ، کاهش تدریجی شناختی ، حرکات غیر طبیعی چشم و تکان خوردن غیر ارادی عضلات صورت و انگشتان دست مشخص می شود. گفته شده است كه فقط بخشى از بيماران مبتلا، تجمع آهن در مغزدارند كه ممکن است در اواخر دوره بیماری توسعه يابد، یا اينكه فقط با جهش های شدیدتری مشاهده شود.
از جمله علائم این بیماری میتوان پارکینسون نوجوانان، زوال عقل، حرکات غیرعادی چشم و پرشهای غیرارادی عضلات صورت و انگشتان را نام برد.
آسرولوپلاسمينميا Aceruloplasminemia
جهش در ژنی به نام CP (تولید کننده سرولوپلاسمین) مسئول آسرولوپلاسمینمی است که نوعی NBIA به حساب می رود. این بیماری همراه با تجمع آهن است با این تفاوت که آهن نه تنها در مغز بلکه در اندام های احشايى (داخلی) از جمله کبد انباشته می شود. این اختلال عمدتا در ژاپن مورد مطالعه قرار گرفته است، جایی که در حدود یک نفر از 2 میلیون بزرگسال مبتلا به اين نوع NBIA است. مشخص نیست چقدر اين بيمارى در جمعیت های دیگر بروز ميكند.
سن شروع بيمارى از 25 تا 60 سال و بالاتر است. مشکلات روانپزشکی در بیماران، شامل افسردگی و اختلال عملکرد شناختی در افراد بالاتر از 50 سال است. متوسط طول عمر در افراد مبتلا به آسرولوپلاسمینمی متفاوت است ، اما به دلیل پیشرفت در مراقبت های پزشکی ، بیشتر افراد مبتلا تا اواخر بزرگسالی به خوبی زندگی می کنند.
علائم اصلی آن شامل تخریب شبکیه ، دیابت و بیماری های عصبی مربوط به تجمع آهن در گانگلیون های پایه است. مشکلات حرکتی شامل دیستونی صورت و گردن, انقباضات غیرارادی عضلات با حرکات تکراری یا حالت های دردناک ، بلفارواسپاسم (اسپاسم پلک) ، لرزش و حرکات تند است.
Wood house-Sakati وودهاوس ساكاتی
این اختلال نوع ديگر NBIA است كه مسبب آن يك تغيير در ژن DCAF17 ميباشد. و با علائم عصبی و علائم مربوط به غدد درون ريز مشخص می شود. به طور معمول اولین علائم سندرم وودهاوس-ساکاتی در افراد از سن 10 سالگی تا اوایل 20 سالگی مشاهده می شود.
این بيمارى در بيمارانى از خاورمیانه ، اروپا ، شمال آفریقا ، هند و پاکستان توصیف شده است. يك جهش اوليه بنيانگذار در موارد بيماران خاورمیانه گزارش شده است. يك تغيير ژنتيكى باعث بروز بيمارى در جمعيت خاورميانه ميباشد. بيشتر بخوانید….
مپان MEPAN Mitochondrial Enoyl CoA Reductase Protein-Associated Neurodegeneration (MEPAN)
تحليل اعصاب مرتبط با پروتئین میتوکندری به نام trans-2-enoyl-CoA reductase که در اثر جهش مغلوب در ژن MECR رخ می دهد، اختلال عصبی نادر است. این پروتئین نقش حیاتی در تولید اسیدهای چرب میتوکندری دارد.
این اختلال حرکتی پیشرونده در دوران کودکی و با آتروفی بینایی مشخص ميشود. اگرچه به نظر نمی رسد كه مپان تجمع آهن مغز را به همراه داشته باشد ، اما هم علائم و هم مناطق درگير مغز با NBIA همخوانى دارد. به همین دليل، تیم NBIAcure كه در کشف ژن نقش داشت، همچنان به این بيمارى “شبيه به NBIA” (NBIA like) توجه دارد.
مپان در افرادى با اصالت یهودی اشکنازی شیوع بیشتری دارد. با این حال ، در افراد دیگر قومیت ها نیز توصیف شده است.
آن بی آی ای ناشناخته NBIA Idiopathic
منشا این اختلال مشخص نيست، اگرچه حدس زده ميشود كه مسبب آن ژنتيكى باشد.
بيمار تشخيص داده شده با این نوع از NBIA برای بسيارى از خانواده ها، اولين و تنها شخص مبتلا به اين بيمارى ميباشد. به اين دليل، دانستن آيا اينكه الگو خاص ارثی وجود دارد، دشوار است.
جهت کسب اطلاعات كاملتر درباره هر یک از اشکال بیماری NBIA ميتوانيد به وبسايت انگليسی نیز رجوع نمائید. www.nbiadisorders.org يا http://nbiacure.org
اطلاعات پزشكی
بررسى اجمالی اطلاعات پزشکی
بیماری تحلیل رفتگی عصبی همراه با رسوب آهن در مغز ان بی آی ای (اختصاراً NBIA) به گروهی از اختلالات عصبی ژنتیکی نادر اطلاق میشود که مشخصه آنها تحلیل پیشرونده سیستم عصبی است.
تا به امروز ده ژن مرتبط با انواع گوناگون این بیماری شناسایی شده است. ژنها و نوع بیماری مرتبط با آنها در جدول زیر نمایش داده شده است.
| PKAN | Pantothenate Kinase-Associated Neurodegeneration | PANK2 |
| PLAN | PLA2G6-Associated Neurodegeneration | PLA2G6 |
| MPAN | Mitochondrial-membrane Protein-Associated Neurodegeneration | C19orf12 |
| BPAN | Beta-propeller Protein-Associated Neurodegeneration | WDR45 |
| CoPAN | COASY Protein-Associated Neurodegeneration | COASY |
| FAHN | Fatty-Acid Dyroxylase-associated Neurodegeneration | FA2H |
| Aceruloplasminemia | CP | |
| Kufor-Rakeb | ATP13A2 | |
| Neuroferritinopathy | FTL | |
| Woodhouse-Sakati Syndrome | DCAF17 |
ویژگی مشترک در کلیه افراد مبتلا به ان بی آی ای، انباشت آهن در مغز همراه با اختلال حرکتی پیشرونده است. این انباشت به ویژه در نواحی گره ههای عصبی قاعده مغز basal ganglia موسوم به “گلبوس پالیدوس” Globus Pallidus و «جسم سیاه» substantia nigra دیده میشود. گره ههای عصبی قاعده مغز مجموعه ای از ساختارهای عصبی واقع در عمق قاعده مغز است که نقش آنها کمک به تنظیم حرکات است. رابطه دقیق بین انباشت آهن و علائم بیماری NBIA به طور کامل شناخته شده نیست.
افراد مبتلا به این بیماری ممکن است طی دورههای طولانی وضعیت یکنواخت داشته باشند و سپس دچار دوره ههای متناوب وخامت سریع گردند. علائم بیماری از فردی به فرد دیگر تفاوت های زیادی دارد که تا حدودی به دلیل ژن های متفاوتی است که عامل بروز این بیماری هستند. جهش های متفاوت در یک ژن نیز میتواند منجر به شدت و ضعف بیماری گردد. عوامل موثر در شدت بیماری و روند پیشرفت آن ناشناخته اند.
اختلالات حرکتی موجب خام دستی ( دست و پا چلفتگي)، دشواری در کنترل بدن و مشکلات گفتاری میگردد. اختلال در کشش طبیعی عضلات (ديستونیا dystonia)، گرفتگی عضلات (اسپاسم (spasticity) و اختلالات بینایی از جمله نشانه های بالینی مشترك آن هستند.
بسیاری از افراد سرانجام توانایی راه رفتن، صحبت کردن و جویدن غذا را از دست میدهند و کاملاً وابسته به دیگران میشوند تا از آنان مراقبت نمایند.
تشخیص آن بی آی ای NBIA
پزشکان معمولاً هنگامی به ابتلای یک فرد به بیماری ان بی آی ای مشکوک میشوند که یافتههای ام آر آی MRI حاکی از انباشت غیر عادی آهن در گرههای عصبی قاعده مغز(basal Ganglia) باشد. گرچه در این قسمت از مغز همه انسان ها آهن وجود دارد، اما در مغز مبتلایان به این بیماری آهن اضافی وجود دارد که در این تصاوير مشهود است. در بعضی از تصاویر MRI-T2 یا (T2-weighted images) آهن به صورت نواحی تاریک در مغز دیده میشود.
بیشترین مقدار آهن غالباً در قسمت هایی از مغز دیده میشود که به آن گلوبوس پالیدوس (globus pallidus) و جسم سیاه ( substantia nigra) می گویند.
بارزترین نشانه های بالینی این بیماری به کارکرد عضلات مربوط میشود و به ويژه اختلال کشش طبیعی عضله یا دیستونی dystonia، اختلال حركتی به علت اختلال عصبی عضله، نارساگویی از قبیل مشکلات گفتاری dysarthria ، گرفتگی عضلات spasticity و پارکینسونیسم (لرزش، کندی حرکات، سفت شدگی عضلات و ضعف تعادل) است که همگی پیشرونده هستند.
این بیماری ممکن است بر بینایی نیز تاثیر گذارد. شایع ترین علائم تحلیل رفتگی پرده شبکیه و آتروفی عصب بینایی است که شامل از بین رفتن همیشگی بعضی یا بیشتر رشته های عصب بینایی است. افت عمومی سلول ها ی عصبی یا افت بافت مغز هم غالباً مشاهده میشود که به آن آتروفی مغز یا مخچه میگویند.
در سلول های عصبی مبتلایان به این بیماری نابهنجاری مشترکی وجود دارد که فقط با بررسی بافت عصبی حاصل از نمونه برداری، توسط میکروسکوپ الکترونیكى قابل شناسایی است. سلولهای عصبی دارای زائده رشته مانندی به نام آکسون هستند که کار انتقال پیام از یک سلول عصبی به سلول کناری را به عهده دارد. در این بیماران بعضی از آکسون ها در اثر تجمع مواد زائد سلولی، كه نبايد آنجا باشند، متورم میشوند. به این تورم اصطلاحاً «اجسام کروی شکل» یا اکسون های متورم میگویند. در بیشتر اختلالات NBIA، این زوائد کروی شکل فقط بر روی اعصاب مغز و نخاع تشکیل میشوند. بنابراین ردیابی آنها فقط پس از مرگ و با کالبد شکافی امکان پذیر است. در پلان PLAN که نوعی از اختلالات NBIA است و موسوم به پلاسیدگى آکسون نوزادان و اختصاراً (INAD Infantile Neuroaxonal Dystrophy) خوانده می شود.
زائدههای كرؤى مذکور در سلولهای عصبی سراسر بدن یافت میشود و با نمونه برداری از پوست، عضله یا سایر بافت ها ميتوان آنها را جستجو نمود. در موارد معدودی در یک نوع بیماری NBIA موسوم به امپان یا تحلیل رفتگی عصبی مرتبط با پروتئین غشای میتوکوندریا و اختصاراً MPAN، زائدههای كرؤى شکل در اعصاب محیطی هم یافت میشود.
تشخیص هر یک از اختلالات NBIA بر اساس یافته های بالینی و آزمایشات ژنتیکی محرز میگردد.
علائم NBIA
علائم عصبی – عضلانی
مرتبط با بیماریهاى ان بی آی ای با عناوین مشترکی توصیف میشوند.
اختلال کشش طبیعی عضله (دیستونیا dystonia)
به معنی گرفتگی غیرارادى عضله است که موجب میشود قسمت های خاصی از بدن دچار حرکات و وضعیت های غیر معمول و بعضى اوقات دردناک گردد.
اختلال در کشش طبیعی (دیستونی)، عضلات دهان و گلو را نیز درگیر میکند که ممکن است موجب اختلال در گفتار و نارساگویی و دشواری بلع گردد. پیشرفت دیستونی در این عضلات میتواند منجر به از دست دادن تکلم و گاز گرفتن کنترل ناپذیر زبان گردد. نوع خاص اختلال کشش طبیعی عضلات (دیستونی) که در ارتباط با بیماری NBIA رخ میدهد، اسپاسم غیر ارادی پلک و کج گردنی blepharospasm and torticollis است. اسپاسم پلک، وضعیتی است که در آن عضلات پلک ها به درستی عمل نكرده و باعث پلک زدن های بیش از حد و بستن غیرارادی پلک ها میگردد. در کج گردنی انقباضات غیرارادی عضلات گردن موجب حرکات و وضعیت های غیرعادی سر و گردن میشود.
حرکات غیرارادی
سریع و پرشی نامنظم و بى هدف (کُره) کروآتتوزیز Choreoathetosis علامت دیگر این بیماری ها است که همراه با حرکت های نسبتاً کند، سینوسی و چرخشى athetosis همراه است.
اسپاسم (spasms)
گرفتگی غیرعادی عضلات، دست ها و پاها نیز دچار سفتی و سختی میشوند به خاطر مقاومت مداوم نسبت به آرامش طبيعى عضلاتی. گرفتگی و سختی عضلات معمولاً در پاها شروع میشود و سپس به دستها سرایت میکند. با بالا رفتن سن ممکن است فرد مبتلا نهایتاً کنترل حرکات ارادی را از دست بدهد. اسپاسم های عضلانی همراه با کاهش جرم استخوان میتواند منجر به شکستگی استخوان گردد بدون آنکه ضربه ای به آن وارد شود.
مشکلات بینایی
بیشتر انواع اختلالات NBIA شامل عوارض بصری چشم هم میشود. شایع ترین مشکلات عبارت از تحلیل رفتگی پرده شبکیه retinal degeneration و آتروفی عصب بینایی optic atrophy هستند.
شبکیه retina غشاء نازکی است که قسمت پشت حدقه چشم را میپوشاند. نقش این پرده کمک به ادراک تصاویر و ارسال آن به مغز است. علائم اولیه تحلیل رفتگی پرده شبکیه، ضعف بینایی در شب یا دید موسوم به دید کانونی است. این وضعیت در نهایت موجب افت قابل ملاحظه بینایی میگردد. آتروفی عصب بینایی درگيری عصب بینایی که کارش ارسال پیام ها بین پرده شبکیه و مغز ميباشد را شامل می شود. عصب بینایی شبیه به کابلى متشکل از هزاران رشته نازک الکتریکی است که هريك بخشى از اطلاعات بینایی را به مغز منتقل میکند. هنگامی که این عصب دچار آسیب دیدگی یا پارگی میشود ممکن است دید تار شده و مشکلات دید جانبی (محیطی) یا دید رنگ های غیر عادی، عارض شوند. همچنين ممکن است مردمک به درستی کار نکند یا میزان روشنایی در یک چشم نسبت به چشم دیگر کاهش یابد. آتروفی عصب بینایی در نهایت موجب نابینایی میگردد.
برای اطلاعات بیشتر به پایین این بخش مراجعه نمایید.
تاخیر در رشد
در بعضی از انواع NBIA ، عمدتاً در مهارت های حرکتی رخ میدهد. یک زیرگروه کوچک از این بیماری با تاخیرهای رشد ذهنی نيز همراه است. اگرچه اختلال و آسيب عقلانى در گذشته به عنوان بخشى از علائم بيمارى شرح داده شده، روشن نيست كه آيا اين برای اكثر افراد مبتلا به ان بی آی ای صحت داشته باشد. از آنجایی که اختلالات حرکتی مانع انجام آزمون های توانایی ذهنی در این بیماران میگردد، لذا تعیین مشکلات شناختی در این بیماران مستلزم روش های جدیدتر مطالعه هوش این افراد است. در برخی از بیمارانى که علائم اولیه بیماری دیرتر بروز میکند، ممكن است، کاهش هوش شناختی رخ دهد.
تشنج
در بعضی از بیماران ان بی آی ای، تشنج رخ میدهد.
اختلالات بینایی
بیشتر انواع NBIA عوارض بصری به همراه دارند. شایع ترین مشکلات چشمی در این بیماران تحلیل رفتگی پرده شبکیه retina degeneration و آتروفی عصب بینایی optic atrophy است. به طور تخمینی 20 الی 30 درصد بیماران مبتلا به نوع کلاسیک پکان PKAN، دچار التهاب رنگ دانه ای شبکیه RP=retinitis pigmentosa میشوند که به عوارضی همچون شب کوری، از دست دادن بینایی محیطی و حتی در بعضی بیماران به نابینایی منجر میگردد.
التهاب رنگ دانهای شبکیه RP=retinitis pigmentosa
برای آنکه بدانیم که التهاب رنگ دانهای شبکیه چه تاثیری بر فرد مبتلا میگذارد، لازم است با طرز کار پرده شبکیه آشنا شویم. پرده شبکیه قسمت پشت چشم را میپوشاند و همچون فیلم در دوربین عکاسی عمل میکند. به این معنا که اين پرده هر آنچه را که شخص میبیند دریافت و پردازش میکند. شبکیه لایه ظریفی از سلولهاى میله ای و مخروطی شکل ميباشد که در ابتدا به نور پاسخ میدهد.
سلول های میله ای حرکت را از گوشه چشم دریافت كرده و در نور ضعیف یا درشب عمل میکنند. در هر چشم حدود 120 میلیون سلول میله ای وجود دارد و هرچه به لبه های بیرونی شبکیه نزدیک میشویم این سلول ها پرشمارتر میشوند. سلولهای مخروطی در بینایی رنگی و کارهای دقیقی که از نزدیک انجام میدهیم مانند خواندن به کار میآیند. این سلول ها بیشتر در مرکز شبکیه متمرکز هستند.
شایع ترین علامت التهاب رنگ دانهای شبکیه، دشواری دید در شب یا ضعف بینایی در روشنایی یا در روشنایی ضعیف است. با از بین رفتن کارکرد سلولهای میله ای میدان دید محدود میشود و با پیشرفت تحلیل رفتگی، بیمار احساس میکند که گویی به درون یک تونل نگاه میکند. به همین خاطر است که التهاب رنگ دانهای شبکیه را بعضاً «دید تونلی یا کانونی» مینامند.
علامت ديگر التهاب رنگ دانه اى شبكيه، دشواری در انطباق با تغییرات روشنایی و تمایز بین برخی از اشیاء ميباشد. مثلاً ممکن است کودکان در کلاس درس در دیدن نوشته های روی تخته با مشکل روبرو شوند يا نوشته هايى كه يك پروژكتور روى پرده اى نشان ميدهد را به سختی بخوانند. بیماران دیگر ممکن است در تشخیص پلکان های بتونی یا مفروش شده که فاقد نشانه گذاری های کناری باشند با مشکل روبرو شوند. سرانجام اين اختلال ممکن است بر دید مرکزی یا دید دقیق فرد برای خواندن جزئیات تاثیر گذارد. این حالت معمولاً در اواخر سیر بیماری رخ میدهد. بعضی افراد ممکن است نابینا شوند.
گرچه با یک معاینه کامل چشم می توان به ابتلای فرد به التهاب رنگ دانه ای شبکیه پی برد، اما بدون انجام آزمایشات بیشتر تشخیص قطعی ناممکن است. آزمایش تشخیص اساسی در این مورد انجام تصویربرداری از شبکیه یا ERG است با این تصویربرداری فعالیت الکتریکی شبکیه در واکنش به تحریک نوری اندازه گیری میشود. لازمه این کار قرار دادن یک لنز تماسی روی چشم بیمار است که الکترودهایی به آن وصل گردیده است، الکترودها واکنش شبکیه را به یک رشته پرتوهای نور در شرایط روشنایی و تاریکی، رصد میکنند.
احتمالاً بیش از ٣٠ اختلال ژنتیکی وجود دارد که التهاب رنگ دانه اى شبکیه از مشخصه های آنان است و پکان PKAN از جمله آنها است. در بعضی از افراد یا خانوادهها التهاب رنگ دانه شبکیه مستقلاً یا بدون ارتباط با عوارض دیگر رخ میدهد. برای این بیماری درمانی وجود ندارد. اما تجربه نشان داده است که مصرف روزانه پانزده هزار واحد بین المللی مکمل ویتامین vitamin A (Palmitate) پیشرفت التهاب رنگ دانه شبکیه را در بعضی افراد تا حدودی، کاهش می دهد. بیمارانی که تحت درمان با ویتامین A قرار میگیرند باید زیرنظر پزشک باشند. مصرف ویتامین A احیاناً تنها در پاره ای از انواع التهاب رنگ دانه ای شبکیه سودمند است و چنانچه تحت مدیریت دقیق پزشک نباشد، میتواند سمی باشد.
اطلاعات كامل در مورد تحقيقات در لینک زير در دسترس است:
The foundation fighting Blindness in Hunt Valley,Md
http://www.blindness.org
آتروفی عصب بینایی optic atrophy
وظیفه عصب بینایی، ارسال پیام مابین شبکیه و مغز است. عصب بینایی مانند کابلی است با هزاران رشته نازک الکتریکی که هر یک بخشی از اطلاعات بینایی را به مغز منتقل میکند. تخریب این عصب هنگامی که دچار آسیب دیدگی یا پارگی میشود میتواند موجب تاری دید و غیر عادی شدن دید جانبی و بینایی رنگی گردد. ضمن آنکه ممکن است مردمک به درستی کار نکند یا میزان روشنایی در یک چشم در مقایسه با چشم دیگر کاهش یابد. آتروفی عصب بینایی نهایتا میتواند موجب نابینایی گردد.
درمان
بوتاکس Botox
تزریق بوتولینوم توکسین (بوتاکس) در عضلاتی که دچار اختلال کشیدگی طبیعی dystonia شدهاند برای چند ماه موجب تسکین و آرامش میگردد. بوتاکس با ایجاد ضعف موقت در عضلات به رفع انقباضات غیرارادی که باعث درد، پیچش و وضعیت غیرعادی عضله یا تغییر در صدا یا گفتار بیمار میشود کمک میکند. تزریق بوتاکس فعالیت عضله را تا آنجا تضعیف میکند که موجب کاهش گرفتگى يااسپاسم میگردد اما در آن حد نیست که موجب فلج شدن گردد. از آنجایی که در هر یک از عضلات درگیر باید جداگانه تزریق شود، این روش هنگامی بیشترین کارایی عملی را دارد که ناحیه خاصی از بدن مانند دست یا فک دچار اختلال در کشیدگی طبیعی عضلانی شده باشد.
نکته مهم آن است كه تزریق ها باید توسط یک پزشک آموزش دیده انجام شود. پزشک باید با خصوصیات بالینی اختلال کشیدگی عضلانی و حرکات غیرارادی بیمار تحت درمان آشنایی داشته باشد. بعضی از پزشکان به منظور تعیین عضلات بیش فعال و اندازه گیری و ثبت فعالیت عضله از یک نوار ماهیچه نگار (EMG) استفاده میکنند.
در هر عضله بیش فعال با یک سوزن کوچک، یک الی سه تزریق صورت ميگيرد. احساس ناراحتی در محل تزریقها معمولاً موقتی است که با استفاده از یک ماده بی حس کننده موضعی میتوان درد ناشی از تزریق را به حداقل رساند.
به طور کلی عوارض جانبی این روش موقتی بوده و خود بخود برطرف میشود، برحسب اینکه کدام قسمت از بدن تحت درمان قرار گرفته باشد بعضی عوارض جانبی شامل ضعف عضلانی، دشواری در بلع، علائم شبه به آنفولانزا و درد در محل تزریقپیش خواهد آمد. برای پیشگیری از این عوارض جانبی می توان میزان تزریق یا محل تزریق را برای نوبت های بعدی تنظیم کرد.
اثرات تزریق بر عضله معمولاً ظرف چند روز پس از تزریق شروع شده و حدوداً پس از چهار هفته به اوج میرسد و بین دو تا چهار ماه دوام دارد.
تأثیر تزریق ها در بعضی افراد ممکن است همیشگی باشد. نتایج حاصل از بیش از یک دهه تجربه بالینی حاکی از آن است که بیمارانی که واکنش خوبی به بوتاکس نشان داده اند میتوانند بدون آنکه دچار عوارض جانبی شوند سالیان سال این روش درمانی را ادامه دهند. در پاره ای موارد دیده شده است که تأثیرات مثبت درمان در بیمارانی که قبلاً با موفقیت درمان شده تدریجاً افت میکند که احتمالاً به خاطر تغییر ماهیت و الگوی انقباضات عضلانی در طول زمان است. این احتمال نیز وجود دارد که پادتن هایی در بدن شخص تولید شود و اثر داروى تزریقی را خنثی کند.
تحریکِ عمقی مغز DBS
تحریک عمقی مغز (اختصارا DBS) گزینه دیگری است که برای درمان اختلال کشش عضلانی dystonia در بیماران مبتلا به NBIA و اکثرا در مورد نوع پکان PKAN مورد استفاده قرار میگیرد. این روش عبارت از قراردادن الکترودهایی در مغز بیمار است. این الکترودها از طریق سیم هایی به یک محرک عصبی که با باطری کار میکند و در قفسه سینه بیمار کارگزاری میشود وصل است. محرک عصبی ضربان هایی را به نواحی موردنظر در مغز ارسال کرده و آن قسمت از مغز را که بیش از اندازه سیگنال (علامت) میفرستد و موجب میگردد که عضلات در جهات دردناک حرکت کنند را به اصطلاح از دور خارج کند.
تحریک عمقی مغز خالی از خطر نیست، هر چند در مراکز مجهز، این خطرات فوقالعاده نادر است. شدیدترین این خطرات خونریزی مغز است. سایر خطرات جراحی شامل عفونت، حمله (تشنج) است.
عوارض جانبی جراحی ممکن است شامل افزایش اختلال کشش عضلانی (ديستونى) و مشکلات گفتاری مانند گفتار مبهم (نارساگویی) dysarthria (یا دشواری در ادای کلمات) و اختلالات بلع يا dysphagia گردد که معمولا برگشت پذیر هستند. در هرحال امکان کل عوارض حادی که ممکن است در این زمینه ایجاد گردند یک الى دو درصد است. به اين دليل، ریسکهای مربوطه در بیمارانی که انتظار میرود نتیجه عمل آنان خوب یا خیلی خوب باشد پذیرفتنی است.
از آنجایی که تعداد محدودی از مبتلایان به بیماری NBIA تحت چنین درمانی قرار گرفتهاند و آنها در مراکز گوناگونی تحت مراقبت بودهاند، ارزیابی کارآیی روش درمانی تحریک عمقی مغز برای چنین جمعیتی در حال حاضر امکانپذیر نیست. اما با وجود این محدودیتها، مطالعات انجام شده حاکی از آن است که روش درمانی تحریک عمقی مغز میتواند نویدبخش باشد. مطالعات وسيعتر ميتواند درك بهترى از عوامل مؤثر در نتيجه استفاده از DBS در NBIA را بدهد.
پمپ داخل مايع نخاع باكلوفن Intrathecal Baclofen Pump
وقتى باكلوفن خوراكى بی اثر شود، پمب داخل مايع نخاعى باكلوفن به بيمار پيشنهاد ميشود. از اينطريق به بيمار باكلوفن لازم از طريق مايع نخاع براى مقابله با اختلال كشيدگى طبيعى، ميرسد. با اين روش مصرف باكلوفن، كمتر از مقدارى است كه از طريق خوراكى داده ميشود و به نسبت پر اثرتر ميباشد. پمب قابل برنامه ريزى و يك كاتتر در بدن بيمار از طرق عمل جراحى گذاشته ميشود كه باكلوفن لازم را بدون توقف به بدن بيمار ميرساند. پمپ بدون ريسك نيست، عوارض احتمالى پمپ باكلوفن، عفونت، خروج باكلوفن يا مصرف زياده از حد باكلوفن ميباشند. چون در حال حاضر تعداد جراحان اعصاب كه اين پمپ را درقسمت فوق گردن ياحفره هاى مغز وارد ميكنند كم است، بهتر است تيم حرفه اى كه از جراحان اعصاب، متخصصان درمان بعد از عمل يا متخصص اختلال حركت كه تجربه با پمپ باكلوفن دارد، تشكيل شود.
پمپ باكلوفن كمتر از تحريك عمقى مغز DPS به بدن بيمار تهاجم دارد. احتمالا DBS گزينه بعدى بهتر برای كنترل كشيدگى طبيعى عضله ميتواند باشد.
داروی دفريپرون Deferiprone
مجموع داده ها در مورد اثرات Deferiprone (با نام تجاری Ferriprox) در گروه های متعددی از بیماران بار دیگر علاقه به عامل چنگك دار آهن iron chelating agent را در پژوهشگران برانگیخته است.
در گذشته نیز عامل چنگكدار يا جذب كننده آهن بدون اینکه فواید روشنی به بار آورده باشد مورد آزمایش قرار گرفته است. تا همین اواخر ایجاد فقر آهن سیستمیک ( آهن لازمه بدن) قبل از آشکار شدن هرگونه سودمندی عصبی بالینی، هر گونه مطالعه اى را در این زمینه محدود میساخت. دفريپرون برخلاف داروهای پیشین از سد خون و مغز عبور کرده و آهن میان سلولی را از مغز خارج میسازد:
به منظور بررسی این موضوع که آیا دفريپرون میتواند از طریق مصرف خوراکی، آهن مغز را خارج سازد یک مطالعه بالینی صورت گرفت. در خلال این مطالعه با انجام معاینات بالینی معلوم گردید که دفريپرون Deferiprone بر سیر بیماری تحلیل رفتگی عصبی از نوع PKAN=Pantothenate kinase-associated Neurodegeneration که یکی از انواع NBIA است، تأثيري دارد. این دارو به مدت هجده ماه در بیش از ۸۰ بیمار مورد آزمایش قرار گرفت. مطالعه مزبور در پنج مرکز واقع در مونیخ (آلمان)، ورشو (لهستان)، میلان (ایتالیا)، نیوکاسل (انگلستان) و اوکلند (کالیفرنیا در ایالات متحده) انجام شد.
این مطالعه با استفاده از روش مطالعه با استاندارد طلایی شامل : گروه شاهد که دارونما مصرف میکنند، روش “تصادفی” و “دو سو کور”، صورت گرفت. منظور از گروه شاهد و دارو نما این است که در جریان مطالعه، Deferiprone را با یک دارونما مقایسه میکند. دارونما ظاهرا کاملا شبیه Deferiprone است اما حاوی هیچ ماده موثرى نیست. شرکت کنندگان در این مطالعه، احتمال دو بر سه براى دریافت داروی Deferiprone و احتمال یک بر سه براى دریافت دارونما را داشتند.
انتخاب به صورت تصادفی، طبق یک فهرست تصادفی تولید شده توسط کامپیوتر، انجام میشود. طبق این فهرست، هر بیمار را در یکی از دو گروه، دریافت کننده دارونما یا دفريپرون، قرار میدهند. برای ارزیابی کامل اثرات درمانی و عوارض جانبی دفريپرون لازم است دارو را با یک گروه شاهد که دارونما دریافت میکند، مورد مقایسه قرار دهند.
منظور از دو سو کور آن است که بیمار و پزشکان نمیدانند که بیمار مورد مطالعه در کدام یک از دو گروه یاد شده، قرار دارند. برای گردآوری عینی دادهههای پژوهش، رعایت این شرط ضروری است.
شرکتکنندگان در این پژوهش از سنین چهار سالگی الى بزرگسال بوده اند و ابتلای آنان به بیماری پکان PKAN باید با آزمایش ژنتیکی مورد تأیید قرار گرفته بود.
بنا به گفته خانم نانسی سوئیترز Nancy Sweeters، هماهنگ کننده سایت پژوهشی مزبور در بیمارستان کودکان و مرکز پژوهش اوکلند، فرایند غربالگری، شامل امضا یک رضایت نامه ساده است که اجازه انتشار برخی اطلاعات پزشکی را میدهد. این اطلاعات شامل تأییدیه آزمایشگاه مبنی بر تشخیص ژنتیکی بیماری پکان PKAN، سابقه پزشکی، داروهای مصرفی کنونی بیمار و نتایج شمارش کامل گلبولهای خونی طی یک سال گذشته بود.
این مطالعه به رهبری دکتر الیوت ویچینسکی در سایت آمریکا با شرکت چهل بیمار آغاز شد.
در دیگر سایت های اروپایی نیز پنجاه بیمار دیگر ثبت نام نمودند.
بودجه این تحقیقات در آمریکا و اروپا توسط اتحادیه اروپا از طريق بودجه كمك مالی TIRCON
Treat Iron-Related Childhood-Onset Neurodegeneration تأمین شده بود. اداره مواد خوراکی و دارویی آمریکا نیز بودجه بخشی از مطالعه را در آمریکا را تقبل نمود. شرکت داروسازی آپوفارما.ApoPharma Inc داروی دفريپرون و دارونماهای مورد نیاز کلیه سایت ها را تأمین کرد. سازمان پژوهشی طرف قرارداد نظارت بر این تحقیقات را به عهده داشت. از شرکتکنندگان در سایت آمریکا خواسته شده بود در طول مطالعه ٦ بار به اوکلند سفر کنند و هزینه ایاب و ذهاب و اقامت را پروژه تحقیقاتی به عهده داشت.
نتایج اين مطالعات مثبت گزارش شد و دفريپرون به کلیه شرکت کنندگان پس از مطالعه بالینی به صورت رایگان داده شد. ارائه رایگان دارو تا زمانی که تأییدی اداره مواد خوراکی و دارویی این دارو صادر نشده بود، ادامه يافت.
براى اطلاعات كاملتر در مورد اين مطالعه بالينى ميتوانيد به متن انگليسى اين ترجمه و يا به آدرس های زیر مراجعه نماييد:
Dr. Mohammad Rohani, Associate Professor of Neurology, Neurology department of Rasoul Akram Hospital, Teheran University of medial Sciences/Iran
[email protected]
U.S. Clinical Trial Center:
Children’s Hospital & Research Center Oakland, Dr. Elliott Vichinsky, PI
[email protected]
Nancy Sweeters, Study coordinator, children’s hospital and research center Oakland
[email protected], Tel. +1- 510-428-3000
Professor Dr. Thomas Klopstock, Friedrich-Baur-Institut an der neurologischen Klinik
Klinikum der Universität München, Innenstadt Ziemensstr. 1, 80336 München
Tel.:+49-89-4400-57474, Fax:+49-89-4400-57402, Universitätsklinikum München
[email protected]
قدردانی
در اين قسمت از خانم پروانه حجت برای تصحیح این متن به زبان فارسی سپاسگزاریم .از خانم آليسون گرگوری Allison Gregory و پروفسور سوزان هـیفلیک Susan Hayflick در ايالات متحده آمريكا و خانم آنجليكا كلوكن Angelika Klucken و دكتر ايوان كارين Ivan Karin و پروفسور توماس كلوپستوك. Thoma klopstock در آلمان، دكتر محمد روحانی، پروفسور غلام علي شهيدى، و پروفسور الهه الهی دکتر فرزاد سینا در ايران برای،كمك و پشتيبانى بيماران آن بی آی ای ايران و همراهى ما در اين گام بسيار سپاسگذاريم.
ترجمه حاضر با پشتيبانى خانم شمسى و آقاى امير حسين زاده، والدین سه فرزند مبتلا به ان بی آی ای از نوع امپان MPAN صورت گرفته است.
مسؤل ترجمه و متن: دكتر فاطمه موله حسين زاده.
کپی این متن یا ویرایش نهایی و یا هر گونه استفاده دیگر از مطالب موجود در آن، باید “NBIA Disorders Association” به عنوان منبع اصلی ذکر شود.
Our thanks to Mrs. Parvaneh Hojat for her efforts in correcting the persian text.
We are thankful to Mrs. Patricia Wood, NBIA disorders association, Dr. Allison Gregory, professor Susan Hayflick in USA, Mrs. Angelika Klucken, Hoffnungsbaum e.v, Dr. Ivan Karin, Dr. Holger Prokisch, professor Thomas Klopstock in Germany, Dr. Mohammad Rohani, professor Gholam Ali Shahidi and professor Elahe Elahi and Dr Farzad Sina in Iran for their advice, help and encouragement to accompany the NBIA patients.
The present translation into Persian has been supported by Mrs. Shamsi and Mr. Amir Hosseinzadeh the parents of three siblings diagnosed with MPAN a subtype of NBIA.
The responsible author of the translation into Persian and the present text:
Dr. Fatemeh Mollet Hosseinzadeh.
References, the source of pictures, drawing, tables:
1. www.nbiadisorders.org
2. http://nbiacure.org
3. www.hoffnungsbaum.com
4. www.tircon.eu
5.GeneReviews®
Neurodegeneration with Brain Iron Accumulation Disorders Overview
“بعضى از اطلاعات از وبسايت NBIAcure.org ترجمه شده.
تصاوير و اطلاعات انگليسى از NBIAcure.org زير حق طبع و نشر Copyright مي باشند.”
“Some information was translated from NBIAcure.org. Images obtained from NBIAcure.org is copyright protected.”
By using any information or any copy of this document, the original source “NBIA Disorders Association” must be mentioned.