کما (اغما) چیست؟
کما یا اغما که از کلمه فرانسوی COMA گرفته شده است نوعی عدم واکنش به محرک های اطراف می باشد که در آن چشمان بیمار بسته است و نمی توان بیمار را از آن برانگیخت. اختلال هوشیاری به اختلالات مشابه و کمتر شدید هوشیاری اشاره دارد؛ این اختلالات کما محسوب نمی شوند. مکانیسم کما یا اختلال هوشیاری شامل اختلال در عملکرد هر دو نیمکره مغزی یا سیستم فعال کننده مشبک (Reticular activating system/RAS) (که به عنوان سیستم انگیختی صعودی (Ascending arousal system) نیز شناخته می شود) می باشد. علل آن ممکن است ساختاری یا غیرساختاری باشد (به عنوان مثال سموم یا اختلالات متابولیک). آسیب ممکن است کانونی یا منتشر باشد. تشخیص آن بالینی است؛ شناسایی علت آن نیاز به تست های آزمایشگاهی و تصویربرداری عصبی دارد. درمان آن شامل پایدار کردن فوری شرایط بیمار و مدیریت ویژه علت اختلال است. درمان کمکی برای کمای طولانی مدت شامل تمرینات محدوده حرکتی منفعل (Passive range-of-motion)، تغذیه روده ای و اقداماتی برای پیشگیری از زخم بستر است.
هوشیاری یا آگاهی مختل یا کاهش یافته به معنی کاهش واکنش به محرک های خارجی است. اختلالات شدید شامل موارد زیر می باشد:
- کما (Coma): بیمار نمی تواند برانگیخته شود، چشم ها بسته است و در پاسخ به هیچ گونه تحریکی باز نمی شوند.
- استوپور (Stupor): بیمار تنها با تحریک شدید فیزیکی می تواند بیدار شود.
سطوح هوشیاری با اختلال کمی شدید اغلب به عنوان لتارژی (Lethargy) یا اگر شدیدتر باشد، ابتاندیشن (Obtundation) نامیده می شود. با این حال تمایز بین سطوح هوشیاری با اختلالات کمتر شدید، اغلب مبهم است. نام گذاری اهمیت کمتری نسبت به توضیحات بالینی دقیق دارد (به عنوان مثال “بهترین سطح پاسخ، برداشتن جزئی اندام برای کاهش فشار در بستر ناخن است.”).
هذیان (Delirium) متفاوت است زیرا اختلالات شناختی آن (توجه، شناخت و سطح هوشیاری) نوسان بیشتری دارند. همچنین هذیان معمولاً برگشت پذیر است. بیماران مبتلا به هذیان ممکن است در دوره های متناوبی از توجه و شناخت مناسب و توجه و شناخت مختل، در گردش باشند.
پاتوفیزیولوژی
حفظ هوشیاری مستلزم عملکرد کامل نیمکره های مغزی و حفظ مکانیسم های برانگیختگی در دستگاه فعال کننده مشبک (RAS) – یک شبکه گسترده از هسته ها و فیبرهای متصل کننده در قسمت فوقانی پل مغزی – مغز میانی و دیانسفال (Diencephalon) خلفی است. بنابراین مکانیسم مختل کننده هوشیاری باید یا اختلال عملکرد نیمکره های مغزی و یا اختلال عملکرد دستگاه فعال کننده مشبک را در خود داشته باشد.
برای حالت کما و اختلال در هوشیاری، اختلال عملکرد مغزی باید دو طرفه باشد. اختلالات یک نیمکره مغزی کافی نیست، هرچند که ممکن است باعث نقایص شدید عصبی شود. با این حال یک ضایعه کانونی بزرگ در یک نیمکره (به عنوان مثال سکته مغزی در شریان مغزی میانی (Middle cerebral artery) سمت چپ) در صورتی هوشیاری را مختل می کند که نیمکره مقابل یا از قبل آسیب دیده یا در اثر آن ضایعه کانونی فشرده شود (به عنوان مثال با ایجاد ادم)؛ که البته نادر است.
معمولاً اختلال عملکرد دستگاه فعال کننده مشبک ناشی از نوعی بیماری است که اثرات متفاوتی دارد، مانند اختلالات سمی یا متابولیک (به عنوان مثال کاهش قند خون یا هیپوگلیسمی (Hypoglycemia)، کاهش اکسیژن خون یا هیپوکسی (Hypoxia)، افزایش اوره خون یا اورمی (Uremia) و مصرف بیش از حد دارو). اختلال عملکرد دستگاه فعال کننده مشبک همچنین می تواند ناشی از ایسکمی کانونی (به عنوان مثال برخی از سکته ها در قسمت فوقانی ساقه مغز)، خونریزی یا اختلال مکانیکی مستقیم باشد.
هر شرایطی که فشار درون جمجمه ای (Intracranial pressure/ICP) را افزایش دهد ممکن است فشار خون رسانی مغزی را کاهش داده و در نتیجه ایسکمی مغزی ثانویه ایجاد کند. ایسکمی مغزی ثانویه ممکن است دستگاه فعال کننده مشبک یا هر دو نیمکره مغزی را تحت تاثیر قرار دهد و باعث کاهش هوشیاری گردد.
هنگامی که آسیب مغزی گسترده است، فتق مغزی شرایط بافت عصبی را به دلیل موارد زیر وخیم تر می کند:
- مستقیماً بافت مغز را فشرده می کند.
- خون رسانی به نواحی مغزی را مسدود می کند.
- ICP را افزایش می دهد.
- ممکن است با انسداد سیستم بطنی مغزی منجر به هیدروسفالی (Hydrocephalus) شود.
- منجر به اختلال عملکرد سلول های عصبی و عروقی می شود.
علاوه بر اثرات مستقیم افزایش ICP بر سلولهای عصبی و عروقی، مسیرهای سلولی آپوپتوز (Apoptosis) و اتوفاژی (Autophagy) (که انواعی از مرگ یا تخریب برنامه ریزی شده سلولی هستند) می تواند فعال شود. آپوپتوز دارای مراحل اولیه و ثانویه است که در نهایت منجر به تخریب دئوکسی ریبونوکلئیک اسید (DNA) در سلول ها میشود. در اتوفاژی اجزای سیتوپلاسمی سلول برای حذف اندامک های بدون عملکرد، بازیافت می شوند .
ضعف هوشیاری ممکن است به کما و در نهایت مرگ مغزی منجر شود.
علت کما (اغما) یا اختلال هوشیاری
کما یا اختلال هوشیاری ممکن است ناشی از اختلالات ساختاری، که معمولاً باعث آسیب کانونی میشوند، باشد؛ یا ناشی از اختلالات غیر ساختاری، که اغلب باعث آسیب های منتشر می شوند (به جدول دلایل متداول کما یا اختلال هوشیاری مراجعه کنید).
افزایش سن خطر ایجاد اختلال هوشیاری را افزایش می دهد .
دلایل متداول کما و اختلال هوشیاری
دلایل متداول بروز حالت کما و اختلال هوشیار به دو دسته اصلی کانونی و منتشر تقسیم می شود:
کانونی
| اختلالات ساختاری | آبسه مغزی. تومور مغزی. تروما یا ضربه به سر (مانند کانکاشن (Concussion)، پارگی بافت مغزی (Cerebral laceration)، له شدگی (Contusion)، هماتوم ساب دورال و اپیدورال (Epidural & subdural hematoma)). هیدروسفالی (حاد). خونریزی داخل پارانشیم مغزی (Intraparenchymal hemorrhage). خونریزی زیر عنکبوتیه (Subarachnoid hemorrhage). سکته یا خونریزی قشر یا قسمت فوقانی ساقه مغز. |
| اختلالات غیر ساختاری | تشنج ها (مانند صرع پایدار غیر حرکتی (Nonconvulsive status epilepticus) یا یک حالت پس از حمله (Postictal) ناشی از یک کانون صرع زا. |
منتشر
| اختلالات غدد درون ریز، ایسکمیک، هیپوکسیک و متابولیک | کتواسیدوز دیابتی (Diabetic ketoacidosis). انسفالوپاتی کبدی (Hepatic encephalopathy). کلسیم خون بالا یا هایپرکلسمی (Hypercalcemia). کربن دی اکسید خون بالا یا هایپرکاپنی (Hypercapnia). قند خون بالا یا هایپرگلایسمی (Hyperglycemia). سدیم خون بالا یا هایپرناترمی (Hypernatremia). کلسیم خون پایین یا هیپوکلسمی (Hypocalcemia) (به ندرت). قند خون پایین یا هیپوگلیسمی (Hypoglycemia). سدیم خون پایین یا هایپوناترمی (Hyponatremia). هیپوکسی/ایسکمی. کم کاری تیروئید. نارسایی تنفسی یا نارسایی قلبی. افزایش اوره خون یا اورمی (Uremia). انسفالوپاتی ورنیکه (Wernicke encephalopathy). |
| عفونت ها | انسفالیت (Encephalitis). مالاریا. مننژیت (Meningitis). سپسیس (Sepsis). |
| سایر اختلالات | آسیب منتشر آکسونی (Diffuse axonal injury). انسفالوپاتی ناشی از فشار خون بالا (Hypertensive encephalopathy). کاهش دمای عمومی بدن یا هیپوترمی (Hypothermia) و افزایش دمای عمومی بدن یا هایپرترمی (Hyperthermia). |
| داروها | الکل بیهوش کننده ها (مانند پروپوفول (Propofol)). داروهای ضد روان پریشی (Antipsychotic drugs)، اگر باعث سندروم نورولپتیک بدخیم (Neuroleptic malignant syndrome) شوند. محرک های سیستم عصبی مرکزی (Central nervous system/CNS) (مانند کوکائین (Cocaine)). مواد افیونی و بی حس کننده های مرتبط. سایر داروهای سرکوب کننده سیستم عصبی مرکزی (CNS depressant). مهارکننده های انتخابی بازجذب سروتونین، اگر باعث ترشح مقادیر بیش از حد سروتونین شوند (سندروم سروتونین (Serotonin syndrome)). |
| سموم | مونوکسید کربن. |
اختلالات روانپزشکی (به عنوان مثال عدم واکنش روانی (Psychogenic unresponsiveness)) می تواند شبیه به اختلال هوشیاری باشد. این اختلال تحت اراده بیمار است و با معاینه عصبی می توان آن را از اختلال هوشیاری واقعی متمایز کرد.
علائم و نشانه های کما (اغما) و اختلالات هوشیاری
هوشیاری در درجات مختلفی کاهش می یابد. محرک های مکرر بیماران را یا اصلاً تحریک نمی کند یا به طور مختصری آنها را برمی انگیزاند.
بسته به علت اختلال، علائم دیگری نیز ممکن است ایجاد شوند (به جدول یافته ها بر اساس مکان مراجعه کنید):
- ناهنجاری های چشم: مردمک ها ممکن است گشاد، کوچک یا نابرابر باشند. ممکن است یک یا هر دو مردمک در موقعیت میانی ثابت شوند. حرکات چشمی ممکن است ناهماهنگ (Dysconjugate) باشند یا اصلاً وجود نداشته باشند (فلج عصب اکولوموتور (Oculomotor paresis)) یا شامل الگوهای غیرمعمول (به عنوان مثال Ocular Bobbing، Ocular dipping، اپسوکلونوس (Opsoclonus)) باشد. ممکن است همی انوپی همونیموس (Homonymous hemianopia) وجود داشته باشد. سایر ناهنجاری ها شامل عدم پلک زدن در پاسخ به تهدید بینایی (جسمی در نزدیکی تماس با چشم) و همچنین از دست دادن رفلکس اکولوسفالیک (Oculocephalic reflex) (عدم حرکت چشم ها در پاسخ به چرخش سر)، رفلکس اکولووستیبولار (Oculovestibular reflex) (عدم حرکت چشم ها در پاسخ به تحریک کالریک (Caloric))، و رفلکس های قرنیه ای.
- اختلال عملکرد سیستم عصبی خودمختار: بیماران ممکن است الگوهای تنفسی غیرطبیعی (تنفس شین-استوکس (Cheyne-stokes) یا بیوت (Biot)) داشته باشند، که گاهی اوقات با فشار خون بالا و ضربان پایین قلب یا برادی کاردی (Bradycardia) (رفلکس کوشینگ (Cushing reflex)) همراه است. ممکن است ایست ناگهانی تنفسی و قلبی ایجاد شود. با این حال اگر اختلال هوشیاری ناشی از عفونت شدید، کم آبی شدید، از دست دادن شدید خون یا ایست قلبی باشد، ممکن است افت فشار خون ایجاد شود.
- اختلال عملکرد حرکتی: ناهنجاری ها شامل شلی (Flaccidity)، همی پارزی (Hemiparesis)، آستریکسی (Asterixis)، میوکلونوس چند کانونی (Multifocal myoclonus)، وضعیت دکورتیکه (Decorticate posturing) (خم شدن آرنج و نزدیک شدن شانه به بدن همراه با کشیده شدن پا) و وضعیت دسربره (Decerebrate posturing) (کشیده شدن اندام و چرخش داخلی شانه) است.
- سایر علائم: اگر ساقه مغز دچار اختلال شده باشد، تهوع، استفراغ، مننژیسموس (Meningismus)، سردرد پس سری، آتاکسی (Ataxia) و افزایش خواب آلودگی ممکن است رخ دهد.
یافته ها براساس مکان |
|
|
مکان |
یافته های غیرطبیعی |
|
آسیب یا اختلال عملکرد در هر دو نیمکره |
تون و واکنش (خم کننده یا بازکننده) متقارن به درد. میوکلونوس (احتمالاً). چرخه های دوره ای تنفس |
|
توده ای در بالای چادرینه مخچه (Supratentorial) که به ساقه مغز فشار می آورد. |
فلج عصب مغزی زوج سوم در چشم همان طرف، همراه با فلج چشمی و گشاد و ثابت شدن مردمک به صورت یک طرفه. گاهی اوقات حضور همی آنوپی همونیموس و عدم حضور واکنش چشمک زدن در پاسخ به تهدید بینایی، در چشم طرف مقابل. |
|
ضایعات در ساقه مغز |
نشانه های غیرطبیعی اولیه در مردمک و عصب اکولوموتور (Oculomotor). رفلکس اکولوسفالیک غیرطبیعی. رفلکس اکولووستیبولار غیرطبیعی. پاسخ های حرکتی نامتقارن. سفتی دکورتیکه (معمولاً به علت ایجاد ضایعات در قسمت فوقانی ساقه مغز) یا سفتی دسربره (معمولاً به علت ضایعات دوطرفه در پل مغزی یا مغز میانی) هایپرونتیلاسیون (Hyperventilation) (معمولاً به علت ضایعات در قسمت فوقانی پل مغزی یا مغز میانی). |
|
ضایعات در مغز میانی (قسمت فوقانی ساقه مغز) |
قفل شدن مردمک ها در موقعیت میانی، مردمک ها غالباً هم اندازه نیستند، همراه با از دست دادن رفلکس های نوری (به علت بیماری های ساختاری یا متابولیکی که باعث از دست دادن تون سمپاتیک و پاراسمپاتیک مردمک میشوند). |
|
اختلال عملکرد سمی-متابولیکی |
حرکات ناگهانی (Roving)، خود به خود و هماهنگ چشم ها در کمای خفیف. موقعیت ثابت چشم در کمای خفیف. رفلکس دهلیزی-چشمی غیرطبیعی. میوکلونوس چند کانونی. آستریکسی (ممکن است به عنوان نوعی میوکلونوس منفی در نظر گرفته شود) سفتی یا شلی دکورتیکه یا دسربره. |
|
* همه این یافته ها در همه بیماران دیده نمی شوند. رفلکس های ساقه مغزی و واکنش های چشم به نور ممکن است در بیمارانی با آسیب یا اختلال عملکرد در هر دو نیمکره، یا در بیمارانی با اختلال عملکرد سمی-متابولیکی، سالم باشند. اما هیپوترمی (Hypothermia)، اوردوز در مصرف داروهای آرامبخش یا استفاده از داروی بیهوشی ممکن است باعث از بین رفتن بخشی از رفلکس های ساقه مغزی شود. |
|
تشخیص حالت کما یا اغما
- شرح حال.
- معاینه فیزیکی کامل.
- معاینه عصبی، از جمله معاینه چشم.
- تست های آزمایشگاهی (به عنوان مثال پالس اکسی متری (Pulse oximetry)، اندازه گیری قند خون در بالین (Bedside glucose measurement)، آزمایش خون و ادرار).
- تصویربرداری عصبی فوری.
- گاهی اوقات اندازه گیری فشار درون جمجمه ای (ICP).
- پونکسیون کمری (Lumbar puncture) یا نوار مغز (Electroencephalography/EEG)، اگر تشخیص نامعلوم باشد.
اگر بیماران در اثر تحریک های مکرر به طور مختصر برانگیخته شوند یا اصلاً برانگیخته نشوند، تشخیص کما و اختلال هوشیاری است. اگر تحریک باعث ایجاد حرکات رفلکسی اولیه شود (به عنوان مثال وضعیت دکورتیکه یا دسربره)، اختلال هوشیاری ممکن است آنقدر عمیق شود که به کما تبدیل گردد.
تشخیص اختلال و پایدارسازی اولیه (راه هوایی، تنفس و گردش خون) باید همزمان انجام شوند. دما برای بررسی کاهش یا افزایش دما بدن (Hypothermia or Hyperthermia) اندازه گیری می شود. در صورت وجود هر یک از این دو، درمان بلافاصله شروع می شود. برای تشخیص سطوح پایین گلوکز، قند خون باید در کنار بالین بیمار اندازه گیری شود و باید فوراً هم اصلاح شود. اگر تروما وجود داشته باشد، گردن تا زمانی که شرح حال بالینی، معاینه فیزیکی یا آزمایش های تصویربرداری آسیب ناپایدار و آسیب به ستون فقرات گردنی را رد کنند، بی حرکت باقی می ماند.
شرح حال
دستبندهای شناسایی پزشکی (Medical identification bracelets) یا محتویات یک کیف پول یا کیف دستی (مانند کارت شناسایی بیمارستان و داروها) ممکن است سرنخ هایی را برای علت اختلال فراهم کند. بستگان، امدادگران، افسران پلیس و هر شاهدی باید در مورد شرایط و محیطی که بیمار در آن پیدا شده مورد بازجویی قرار گیرند. ظروفی که ممکن است حاوی مواد غذایی، الکل، داروها یا سموم باشند باید برای شناسایی (به عنوان مثال شناسایی دارو با کمک مرکز سم شناسی) و احتمالاً تجزیه و تحلیل شیمیایی، مورد بررسی قرار گیرند و ذخیره شوند.
باید از بستگان بیمار درباره موارد زیر پرسید:
- شروع و دوره زمانی اختلال (به عنوان مثال آیا تشنج، سردرد، استفراغ، ضربه به سر یا مصرف دارو مشاهده شد؟ علائم چگونه به سرعت ظاهر شد؟ دوره بیماری پیشرونده بوده یا متناوب؟)
- وضعیت روانی پایه بیمار
- عفونت های اخیر و احتمال مواجهه با عفونت ها
- سفرهای اخیر
- مصرف وعده های غذایی غیرمعمول
- مشکلات و علائم روانی
- سابقه داروهای تجویزی
- استفاده از الکل و سایر داروهای تفریحی (مانند داروهای بیهوشی، محرک و سرکوب کننده)
- بیماریهای سیستمیک قبلی و کنونی، از جمله نارسایی قلبی جدید، آریتمی (Arrhythmia)، اختلالات تنفسی، عفونت ها و اختلالات متابولیک، کبدی یا کلیوی
- آخرین باری که بیمار طبیعی بود.
- هرگونه تصوری که ممکن است در مورد علت اختلال داشته باشند (به عنوان مثال اوردوز پنهانی، ضربه احتمالی و پنهانی به سر به دلیل مسمومیت اخیر)
جهت تشخیص کما یا اغما سوابق پزشکی در صورت وجود باید بررسی شود.
معاینه فیزیکی کامل
جهت تشخیص دقیق تر حالت اغما یا کما معاینه فیزیکی باید متمرکز و کارآمد و شامل معاینه کامل سر و صورت، پوست و اندام ها باشد.
علائم ضربه به سر شامل خون مردگی (Ecchymosis) دور چشم (چشم راکونی)، خون مردگی پشت گوش (علامت جنگ (Battle sign))، هموتیمپانوم (Hemotympanum)، ناپایداری فک بالا و نشت مایع مغزی-نخاعی (Cerebrospinal fluid/CSF) از بینی و گوش (Rhinorrhea & Otorrhea) است. اگر سر به دقت بررسی نشود، له شدگی اسکالپ (Scalp) و سوراخ های کوچک گلوله میتوانند از دید مخفی بمانند.
اگر آسیب ناپایدار و آسیب ستون فقرات گردنی رد شده باشد، گردن به صورت غیرفعال خم میشود. سفتی نشان دهنده خونریزی زیر عنکبوتیه یا مننژیت است.
یافته های زیر ممکن است علتی را نشان دهند:
- هایپوترمی: مواجهه محیطی، حالتی نزدیک به غرق شدن، مصرف بیش از حد آرام بخش، کم کاری شدید تیروئید، انسفالوپاتی ورنیکه، یا سپسیس در افراد مسن
- هایپرترمی: گرمازدگی، عفونت، مصرف بیش از حد مواد محرک یا سندرم نورولپتیک بدخیم
- تب، بثورات پتشی یا پورپورا (Petechial or purpuric rash)، افت فشار خون یا عفونت شدید اندام های انتهایی (به عنوان مثال قانقاریای یک یا چند انگشت): عفونت سپسیس یا سیستم عصبی مرکزی (Central nervous system/CNS)
- علامت سوزن ناشی از تزریق: مصرف بیش از حد دارو (به عنوان مثال مواد مخدر یا انسولین)
- گزیدگی زبان: تشنج
- بوی تنفس: الکل، مسمومیت های دارویی دیگر یا کتواسیدوز دیابتی
- افت فشار خون یا اختلالات در نبض: اختلال در عملکرد قلب همراه با کاهش خون رسانی
معاینه عصبی
معاینه عصبی به ما می گوید که آیا ساقه مغز سالم است و نیز اینکه محل ضایعه در CNS کجاست. معاینه بر موارد زیر متمرکز است:
- سطح هوشیاری
- چشم ها
- عملکرد حرکتی
- رفلکس های تاندونی عمیق
سطح هوشیاری با تلاش برای بیدار کردن بیماران ابتدا با دستورات شفاهی، سپس با محرکهای غیر دردناک و در نهایت با محرک های دردناک (به عنوان مثال فشار بر روی برجستگی سوپرااوربیتال (Supraorbital ridge)، بستر ناخن یا جناغ) ارزیابی می شود.
مقیاس کمای گلاسکو (Glascow Coma Score) (به جدول مقیاس کما گلاسکو مراجعه کنید) برای ارزیابی بیمارانی با ضربه به سر ایجاد شد. نمره تعیین شده توسط مقیاس برای پیش آگهی ضربه به سر ارزشمند است. این مقیاس برای کما یا اختلال هوشیاری، به هر دلیلی که باشد، مورد استفاده قرار می گیرد؛ زیرا اندازه گیری عینی نسبتاً قابل اعتمادی از شدت عدم واکنش است و می تواند به صورت متناوب برای نظارت بیمار استفاده شود. این مقیاس امتیازات را بر اساس پاسخ به محرک ها تعیین می کند.
باز کردن چشم ها، تغییر حالت صورت و دور کردن هدفمند اندام ها از یک محرک دردناک نشان می دهد که اختلال هوشیاری شدید نیست. پاسخ های حرکتی نامتقارن به درد یا رفلکس های تاندونی عمیق ممکن است ضایعه ای کانونی در نیمکره را نشان دهد.
مقیاس کمای گلاسکو |
||
|
منطقه مورد ارزیابی |
پاسخ |
نمرات |
|
باز شدن چشم ها |
به صورت خود به خودی باز میشوند؛ در حالت پایه، چشم ها باز هستند و پلک میزنند. |
4 |
|
در پاسخ به دستور شفاهی، گفتار و فریاد باز میشوند. |
3 |
|
|
در پاسخ به دردی که بر روی اندام ها یا جناغ وارد میشود، باز میشوند. |
2 |
|
|
هیچ یک. |
1 |
|
|
گفتار |
جهت دار است. |
5 |
|
مکالمه گیج کننده است ولی بیمار میتواند به سوالات پاسخ دهد. |
4 |
|
|
پاسخ های نامناسب؛ کلمات قابل درک هستند. |
3 |
|
|
گفتار غیر قابل درک است. |
2 |
|
|
هیچ یک. |
1 |
|
|
حرکت |
دستورات حرکتی را انجام میدهد. |
6 |
|
با حرکات هدفمند به درد پاسخ میدهد. |
5 |
|
|
از محرک دردناک دوری میکند. |
4 |
|
|
با خم کردن غیرطبیعی، به درد پاسخ میدهد (وضعیت دکورتیکه) |
3 |
|
|
با باز کردن غیرطبیعی، به درد پاسخ میدهد (وضعیت دسربره) |
2 |
|
|
هیچ یک. |
1 |
|
|
* به طور معمول مجموع نمرات کمتر از 8 به عنوان کما در نظر گرفته میشود. |
||
با عمیق شدن اختلال هوشیاری به سمت کما، محرک های دردناک ممکن است باعث ایجاد وضعیت رفلکس کلیشه ای (Stereotypic reflex posturing) شوند.
وضعیت دکورتیکه می تواند در اختلالات ساختاری یا متابولیک رخ دهد و نشان دهنده آسیب به نیمکره همراه با حفظ مراکز حرکتی در قسمت فوقانی ساقه مغز (به عنوان مثال راه روبرواسپاینال (Rubrospinal tract)) است.
وضعیت دسربره نشان می دهد که مراکز حرکتی قسمت فوقانی ساقه مغز، که خم کردن را تسهیل می کند، از نظر ساختاری آسیب دیده و تنها مراکز موجود در قسمت تحتانی ساقه مغز (به عنوان مثال راه وستیبولواسپاینال (Vestibulospinal tract) و راه رتیکولواسپاینال (Reticulospinal))، که باز کردن را تسهیل می کند، به محرک های حسی پاسخ می دهند.
در اختلالات منتشری مانند انسفالوپاتی انوکسیک (Anoxic encephalopathy)، وضعیت دسربره نیز ممکن است رخ دهد، هرچند که شیوع کمتری دارد.
شل شدگی بدون حرکت نشان می دهد که قسمت تحتانی ساقه مغز بر حرکت تاثیر نمی گذارد؛ چه طناب نخاعی آسیب دیده باشد چه نه. این بدترین پاسخ حرکتی ممکن است.
آستریکسی و میوکلونوس چندکانونی، اختلالات متابولیکی مانند اورمی، آنسفالوپاتی کبدی، انسفالوپاتی هیپوکسیک (Hypoxic encephalopathy) و مسمومیت با دارو را نشان می دهد.
عدم واکنش روانی را می توان جدا دانست؛ زیرا اگرچه معمولاً پاسخ حرکتی ارادی وجود ندارد، اما تون عضلانی و رفلکس های تاندونی عمیق طبیعی هستند و تمامی رفلکس های ساقه مغز حفظ می شوند. علائم حیاتی معمولاً تحت تأثیر قرار نمی گیرند.
معاینه چشم
جهت تشخیص کما از طریق معاینه چشم موارد زیر مورد ارزیابی قرار می گیرد:
- پاسخ های مردمک
- حرکات خارج چشمی
- فوندوس ها (Fundi)
- سایر رفلکس های عصبی-چشمی
پاسخ های مردمک و حرکات خارج چشمی اطلاعاتی در مورد عملکرد ساقه مغز در اختیار می گذارند (به جدول تفسیر پاسخ مردمک و حرکات چشمی مراجعه کنید). معمولاً در اوایل کمایی که به دلیل ضایعات ساختاری ایجاد شده، یک یا هر دو مردمک ثابت می شوند، اما اگر کما به دلیل اختلالات متابولیک منتشر است (که انسفالوپاتی سمی-متابولیکی نامیده می شود)، پاسخ های مردمک اغلب تا مراحل آخر سالم هستند، اگرچه ممکن است ضعیف شده باشند. اگر یکی از مردمک ها گشاد باشد، باید علل دیگر عدم تقارن مردمک های چشم یا آنیزوکوریا (Anisocoria) را در نظر گرفت؛ که شامل ترومای چشمی در گذشته، بعضی از سردردها و استفاده از پچ اسکوپولامین (Scopolamine) (در صورت تماس دارو با چشم) می باشند.
تفسیر پاسخ مردمک و حرکات چشمی |
||
|
منطقه مورد ارزیابی |
یافته |
تفسیر |
|
مردمک ها |
واکنش ضعیف به نور باقی می ماند، تا زمانی که دیگر رفلکس های ساقه مغز نیز از بین بروند. |
اختلال عملکرد منتشر سلول های مغزی (انسفالوپاتی سمی-متابولیکی) |
|
گشادی مردمک در یک طرف، عدم پاسخ به نور. |
فشار بر روی زوج سوم عصب مغزی (مانند فتق ترانس تنتوریال (Transtentorial))، معمولاً به علت ضایعاتی در همان طرف (به آنیزوکوریا مراجعه کنید). |
|
|
مردمک های ثابت در موقعیت میانی. |
اختلال عملکرد مغز میانی به دلیل آسیب ساختاری (به عنوان مثال سکته و خونریزی) فتق مرکزی (Central herniation) اختلال متابولیک (Metabolic depression) شدید به علت داروها یا سموم (سایر رفلکس های ساقه مغز نیز از بین رفته اند) |
|
|
مردمک های منقبض (با قطر 1 میلی متر) |
خونریزی شدید در پل مغزی مسمومیت به علت مواد افیونی یا بعضی از حشره کش ها (مانند ارگانوفسفره ها (Organophosphates) و کاربامات ها (Carbamates) |
|
|
حرکات چشمی |
نشانه های اولیه و غیر طبیعی در مردمک و عصب اوکولوموتور |
ضایعات اولیه در ساقه مغزی |
|
حرکات ناگهانی (Roving)، خود به خود و هماهنگ چشم ها، اما سالم بودن تمام رفلکس های ساقه مغزی |
انسفالوپاتی سمی-متابولیکی زودرس |
|
|
خیره شدن چشم ها، با ارجحیت به یک سمت |
ضایعه در ساقه مغزی در سمت مخالف ضایعه در نیمکره مغزی در سمت موافق |
|
|
عدم وجود حرکات چشمی |
آزمایشات بیشتر مورد نیاز است (به عنوان مثال رفلکس های اکولوسفالیک و اکولووستیبولار) احتمالاً مسمومیت ناشی از فنوباربیتال (Phenobarbital) یا فنی توئین (Phenytoin)، انسفالوپاتی ورنیکه، بوتولیسم (Botulism) یا مرگ مغزی |
|
فوندوس باید بررسی شود. ادم پاپی (Papilledema) ممکن است نشان دهنده ICP باشد، اما ممکن است ساعت ها طول بکشد تا ظاهر گردد. افزایش ICP می تواند باعث تغییرات اولیه در فوندوس شود؛ مانند از دست دادن نبض وریدی شبکیه، پرخونی دیسک (Disk hyperemia)، گشادی مویرگ ها، تار شدن حاشیه داخلی دیسک و گاهی خونریزی. خونریزی ساب هیالوئید (Subhyaloid hemorrhage) ممکن است نشان دهنده خونریزی زیر عنکبوتیه باشد.
رفلکس اکولوسفالیک با مانور چشم عروسکی (Doll’s eye maneuver) در بیمارانی که واکنش نشان نمی دهند مورد آزمایش قرار می گیرد: چشم ها مورد مشاهده قرار می گیرند در حالی که سر به صورت غیرفعال از پهلو به پهلو چرخانده یا خم و کشیده می شود. نباید این مانور را در صورت مشکوک بودن به بی ثباتی ستون فقرات گردنی، انجام داد.
- در صورت وجود رفلکس، مانور باعث حرکت چشم ها در خلاف جهت چرخش، خم شدن یا کشیده شدن سر می شود و نشان می دهد که مسیرهای چشمی در ساقه مغز سالم است. بنابراین در بیماری که به پشت دراز کشیده، هنگامی که سر به طرف دیگر چرخانده میشود، چشم ها همچنان مستقیم به بالا نگاه می کنند.
- اگر رفلکس وجود نداشته باشد، چشم ها در هر جهتی که سر چرخانده شده باشد، حرکت و در نتیجه اشاره میکنند، که نشان می دهد مسیرهای اکولووستیبولار مختل شده است. این رفلکس همچنین در اکثر بیماران مبتلا به عدم واکنش روانی وجود ندارد زیرا تثبیت بصری فرآیندی آگاهانه است.
اگر بیمار بیهوش است و رفلکس اکولوسفالیک وجود نداشته باشد یا گردن بی حرکت باشد، آزمایش اکولووستیبولار (کالریک سرد) انجام می شود. پس از اینکه یکپارچگی پرده گوش تأیید شد، سر بیمار 30 درجه بالا می رود و معاینه کننده با سرنگ متصل به یک کاتتر انعطاف پذیر، 50 میلی لیتر آب یخ را در مدت 30 ثانیه به مجرای گوش خارجی می دهد.
- در صورت انحراف هر دو چشم به سمت گوش آب داده شده، رفلکس ساقه مغز به طور عادی عمل می کند که نشان دهنده اختلال خفیف هوشیاری است.
- اگر نیستاگموس (Nystagmus) نیز دور از گوش آب داده شده رخ دهد، بیمار هوشیار می باشد و عدم واکنش روانی محتمل است. در بیماران هوشیار، 1 میلی لیتر آب یخ اغلب برای ایجاد انحراف چشم و نیستاگموس کافی است. بنابراین در صورت مشکوک بودن به عدم واکنش روانی، باید از مقدار کمی آب استفاده کرد (یا آزمایش کالریک نباید انجام شود) زیرا آزمایش کالریک سرد می تواند باعث سرگیجه شدید، حالت تهوع و استفراغ در بیماران هوشیار گردد.
- اگر چشم ها حرکت نکنند یا حرکت آنها پس از آب دادن ناهماهنگ شود، یکپارچگی ساقه مغز نامشخص و کما عمیق تر است. ممکن است پیش آگهی مطلوب نباشد.
نکته مهم: اگر تون عضلانی، رفلکس های تاندونی عمیق و پاسخ به مانور چشم عروسکی طبیعی باشد، به عدم واکنش روانی شک کنید.
الگوهای تنفسی
نرخ و الگوی تنفس خود به خود باید مستند شود مگر اینکه مداخله اضطراری در مسیر هوایی لازم باشد. این ویژگی ممکن است علت را نشان دهد.
چرخه دوره ای تنفس (تنفس شین-استوکس یا بیوت) ممکن است نشان دهنده اختلال عملکرد هر دو نیمکره یا دیانسفال باشد.
افزایش تهویه (هایپرونتیلاسیون عصبی مرکزی (Central neurogenic hyperventilation)) با بیش از 25 تنفس در دقیقه ممکن است نشان دهنده اختلال عملکرد مغز میانی یا قسمت فوقانی پل مغزی باشد.
بریده بریده نفس کشیدن با وقفه های تنفسی حدود 3 ثانیه پس از دم عمیق (تنفس آپنوستیک (Apneustic breathing)) معمولاً ضایعات پل مغزی یا بصل النخاع را نشان می دهد. این نوع تنفس اغلب به ایست تنفسی منجر می شود.
آزمایش کردن
در ابتدا پالس اکسی متری، اندازه گیری گلوکز پلاسما با نمونه برداری از خون انگشت و نظارت بر قلب انجام می شود.
آزمایش خون باید شامل یک پنل متابولیک جامع (حداقل شامل الکترولیت های سرم، نیتروژن اوره خون (Blood urea nitrogen/BUN)، سطح کراتینین و کلسیم)، شمارش کامل خون (Complete blood count/CBC) با ترکیب سلولی و پلاکت ها، آزمایشات کبدی و سطح آمونیاک باشد.
گازهای خون شریانی (Arterial blood gas/ABG) اندازه گیری می شود. در صورت مشکوک بودن به مسمومیت با مونوکسید کربن، سطح کربوکسی هموگلوبین (Carboxyhemoglobin) اندازه گیری می شود.
خون و ادرار باید برای کشت و غربالگری معمول سم شناسی تهیه شود. سطح اتانول سرم نیز اندازه گیری می شود. سایر پنل های غربالگری سم شناسی و آزمایش های سم شناسی دیگر (به عنوان مثال سطح سرمی دارو) بر اساس شک بالینی انجام می شود.
نوار قلب (12 اشتقاقی) نیز برای بررسی سکته قلبی و آریتمی های جدید انجام می شود.
برای بررسی بیماری جدید ریوی که ممکن است بر اکسیژن رسانی به مغز تاثیر بگذارد، باید رادیوگرافی قفسه سینه انجام شود.
اگر علت اختلال بلافاصله شناسایی نشد، باید در اسرع وقت CT بدون کنتراست از سر انجام شود تا توده ها، خونریزی، ادم، شواهدی از آسیب استخوان و هیدروسفالی (Hydrocephalus) بررسی شود. در ابتدا و برای رد خونریزی مغزی، CT بدون کنتراست نسبت به CT با کنتراست ارجح است. در صورتی که MRI فوراً بتواند آماده شود، میتواند جایگزین CT گردد. اما سرعت MRI به اندازه CT اسکن های نسل جدید نیست و ممکن است برای آسیب های ناشی از ضربه استخوان (به عنوان مثال شکستگی جمجمه) حساس نباشد. اگر CT بدون کنتراست کمکی به تشخیص نکند، می توان از MRI یا CT با کنتراست استفاده کرد. ممکن است هماتوم های ساب دورال ایزودنس (Isodense subdural hematoma)، متاستازهای متعدد، ترومبوز سینوس ساژیتال (Sagittal sinus thrombosis)، انسفالیت هرپسی (Herpes encephalitis) یا سایر عللی که توسط CT بدون کنتراست نمایان نشده را تشخیص دهد.
CT بدون کنتراست از سر
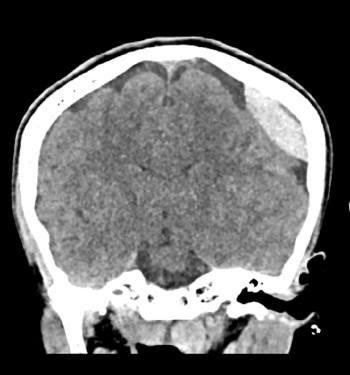
هایپردنسیتی (Hyperdensity) معمول عدسی شکل که از خطوط سوچورهای جمجمه فراتر نرفته است.
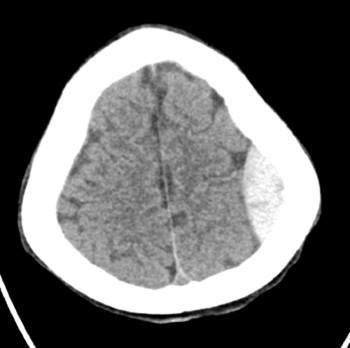
هایپردنسیتی (Hyperdensity) معمول عدسی شکل که از خطوط سوچورهای جمجمه فراتر نرفته است.
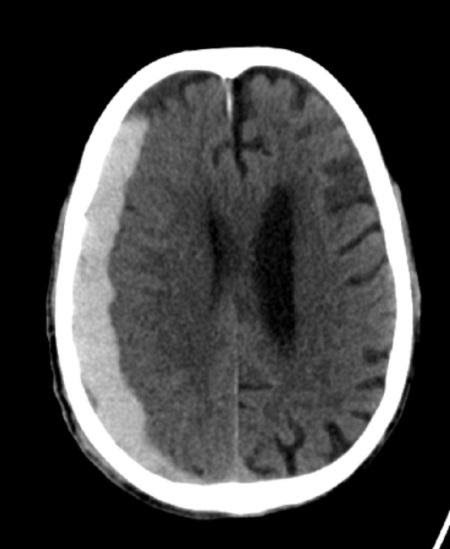
هایپردنسیتی معمول هلالی شکل که از خطوط سوچورهای جمجمه فراتر رفته است.
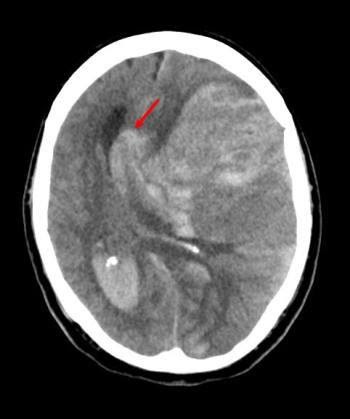
فتق ساب فال سین شایع ترین نوع فتق مغزی است. در این تصویر، فتق مغزی در زیر لبه آزاد داس مغزی (Falx cerebri) (پیکان) مغز چپ فتق کرده است؛ به این علت که خونریزی ناشی از سکته در شریان مغزی میانی باعث افزایش فشار داخل مغزی شده است.
اگر همچنان پس از MRI یا CT و سایر آزمایشات کما غیرقابل توضیح باشد، پونکسیون کمری (Lumbar puncture) (اسپاینال تپ (Spinal tap)) برای بررسی فشار خروجی و رد عفونت، خونریزی زیر عنکبوتیه و سایر ناهنجاری ها انجام می شود. با این حال تصاویر MRI یا CT ابتدا باید برای توده های داخل جمجمه، هیدروسفالی انسدادی (Obstructive hydrocephalus) و سایر ناهنجاری هایی که می توانند جریان مایع مغزی-نخاعی یا سیستم بطنی را مسدود کرده و در نتیجه ICP را به میزان قابل توجهی افزایش دهند، بررسی شود. پونکسیون کمری نباید در صورت وجود چنین ناهنجاری هایی انجام شود. کاهش ناگهانی فشار مایع مغزی-نخاعی، همانطور که ممکن است در حین پونکسیون کمری رخ دهد، در بیمارانی با ICP افزایش یافته می تواند باعث ایجاد فتق مغزی شود. با این حال چنین عارضه ای شایع نیست.
تجزیه و تحلیل مایع مغزی-نخاعی شامل شمارش سلول ها و ترکیب سلولی آن، پروتئین، گلوکز، رنگ آمیزی گرم، کشت و گاهی اوقات، بر اساس شک بالینی، یک سری آزمایشات خاص (به عنوان مثال آزمایش آنتی ژن کریپتوکوک (Cryptococcal antigen test)، سیتولوژی (Cytology)، اندازه گیری نشانگرهای تومور، آزمایشگاه تجسس بیماری های آمیزشی (Venereal disease research laboratory/VDRL)، واکنش زنجیره ای پلیمراز (Polymerase chain reaction/PCR) برای هرپس سیمپلکس (Herpes simplex)، تجزیه و تحلیل بصری یا اسپکتروفتومتری (Spectrophotometry) برای زانتوکرومیا (Xanthochromia)).
در صورت شک به افزایش ICP، فشار مایع مغزی-نخاعی اندازه گیری می شود. در صورت افزایش ICP، این فشار به طور مداوم تحت نظارت قرار می گیرد و اقدامات لازم برای کاهش آن صورت می گیرد.
اگر احتمالاً تشنج باعث کما شده باشد، به ویژه اگر صرع پایدار غیر حرکتی (Nonconvulsive status epilepticus) (تشنج های مکرر بدون علائم حرکتی برجسته) مدنظر باشد، یا اگر تشخیص نامشخص باشد، ممکن است نوار مغز انجام شود. در اکثر بیمارانی که در کما هستند، نوار مغز کند شدن و کاهش دامنه موج را نشان می دهد که البته غیر اختصاصی است اما اغلب در انسفالوپاتی سمی-متابولیکی رخ می دهد. در برخی از بیماران مبتلا به صرع پایدار غیر حرکتی، نوار مغز اسپایک ها، امواج تیز یا کمپلکس های اسپایک و کند را نشان می دهد. اگر عدم واکنش روانی یا فعالیت تشنجی (تشنج کاذب) ناشی از اختلال رفتاری امکان پذیر باشد، نظارت ویدیویی بر نوار مغز لازم است.
سفرهای اخیر – بسته به مقصد سفر – انجام آزمایشات عفونت های باکتریایی، ویروسی و انگلی که ممکن است منجر به کما شود، را الزامی می کند.
پزشکان می توانند از پتانسیل های برانگیخته مانند پتانسیل های شنوایی برانگیخته در ساقه مغز برای ارزیابی عملکرد ساقه مغز یا پتانسیل های برانگیخته حسی-پیکری برای ارزیابی مسیرهای قشر، تالاموس، ساقه مغز و نخاع (به عنوان مثال پس از ایست قلبی) را در نظر بگیرند.
پیش آگهی
پیش آگهی برای بیماران مبتلا به کما (اغما) و اختلال هوشیاری به علت، مدت و عمق اختلال هوشیاری و کما بستگی دارد. به عنوان مثال عدم وجود رفلکس های ساقه مغز پس از ایست قلبی، اما نه لزوماً بعد از اوردوز داروهای آرامبخش، نشان دهنده پیش آگهی نامناسب است. به طور کلی اگر مدت عدم پاسخگویی کمتر از 6 ساعت طول بکشد، پیش آگهی مطلوب تر است.
پس از کما، نشانه های پیش آگهی زیر مطلوب تلقی می شوند:
- بازگشت زود هنگام گفتار (حتی اگر نامفهوم باشد).
- حرکات خود به خودی چشم که می تواند اشیاء را دنبال کند.
- تون طبیعی عضلات در حال استراحت.
- توانایی انجام دستورات.
اگر علت بیماری برگشت پذیر باشد (به عنوان مثال مصرف بیش از حد آرام بخش و برخی از اختلالات متابولیک مانند اورمی)، بیماران ممکن است تمام رفلکس های ساقه مغز و تمام واکنش های حرکتی خود را از دست بدهند و در عین حال به طور کامل بهبود یابند. پس از ضربه، نمره مقیاس کما گلاسکو از 3 تا 5 ممکن است نشان دهنده آسیب کشنده به مغز باشد، به ویژه اگر مردمک ها ثابت باشند یا رفلکس های چشمی وجود نداشته باشد.
پس از ایست قلبی، پزشکان باید مخدوش کننده های عمده کما، از جمله داروهای آرامبخش، بلوک عصبی-عضلانی (Neuromuscular blockade)، کاهش دمای بدن، اختلالات متابولیک و نارسایی شدید کبدی یا کلیوی را رد کنند. اگر رفلکس های ساقه مغز در روز اول وجود نداشته باشد یا بعداً از بین برود، باید جهت مرگ مغزی آزمایش انجام شود.
در صورت داشتن موارد زیر موارد پیش آگهی ضعیف است:
- صرع پایدار میوکلونیک (Myoclonic status epilepticus) (انقباض دو طرفه و همزمان ساختارهای محوری، که اغلب با باز شدن چشم و انحراف آن به سمت بالا همراه است) که طی 24 تا 48 ساعت پس از ایست قلبی رخ می دهد.
- 24 تا 72 ساعت پس از ایست قلبی، هیچ رفلکس نوری ای در مردمک وجود ندارد.
- 72 ساعت پس از ایست قلبی رفلکس قرنیه وجود ندارد.
- 72 ساعت پس از ایست قلبی، بدن در وضعیت کشیده (Extensor posturing) بوده یا به محرک های دردناک پاسخ نمی دهد.
- پس از تحریک پتانسیل برانگیخته حسی-پیکری (Somatosensory evoked potential/SEP)، تا 20 میلی ثانیه پاسخی داده نمی شود (N20).
- سطح سرمی انولاز اختصاصی نورون بیشتر از 33 میکروگرم در لیتر باشد.
- اختلالات قبلی مانند بیماری عروق کرونر، فشار خون بالا و دیابت.
در صورت درمان بیمارانی با هیپوترمی، 72 ساعت باید به زمان های فوق اضافه شود زیرا هیپوترمی روند بهبودی را کند می کند. اگر هر یک از معیارهای فوق وجود داشته باشد، نتیجه معمولاً (اما نه همیشه) ضعیف است. بنابراین اینکه باید دستگاه حمایت کننده از حیات را قطع کرد یا نه، ممکن است یک تصمیم دشوار باشد.
بیماران بسته به علت و مدت اختلال هوشیاری، ممکن است عوارض عصبی و غیر عصبی دیگری نیز داشته باشند. به عنوان مثال، یک دارو یا اختلالی که باعث کمای متابولیک می شود، میتواند باعث افت فشار خون، آریتمی، سکته قلبی یا ادم ریوی نیز گردد. بستری شدن طولانی مدت در ICU همچنین ممکن است منجر به پلی نوروپاتی (Polyneuropathy)، میوپاتی (Myopathy) و سایر عوارض شود (به عنوان مثال آمبولی ریه، زخم بستر و عفونت ادراری).
درمان کما (اغما) و اختلال هوشیاری
- تثبیت فوری بیمار (راه هوایی (Airway)، تنفس (Breathing)، گردش خون (Circulatory) (یا ABC))
- بستری شدن در بخش مراقبت های ویژه (ICU)
- اقدامات حمایتی، از جمله کنترل ICP (در صورت لزوم)
- درمان اختلال زمینه ای
باید فوراً خیال خود را از راه هوایی، تنفس و گردش خون راحت کنیم. افت فشار خون باید اصلاح شود. بیماران مبتلا به اختلال هوشیاری در بخش مراقبت های ویژه بستری می شوند تا بر وضعیت تنفسی و عصبی آنها نظارت شود. در صورتی که فشار خون بالا باشد، باید با دقت کاهش یابد. کاهش فشار خون زیر سطح معمول بیمار می تواند منجر به ایسکمی مغزی شود.
از آنجا که برخی از بیمارانی که در کما هستند دچار سوءتغذیه و مستعد ابتلا به انسفالوپاتی ورنیکه می شوند، باید به طور منظم 100 میلی گرم تیامین را به صورت درون وریدی یا داخل عضلانی تزریق کرد. اگر گلوکز پلاسما پایین باشد، باید 50 میلی لیتر دکستروز 50 درصد را به صورت درون وریدی به بیمار داده شود؛ اما تنها پس از تجویز تیامین.
اگر ضربه وجود داشته باشد، گردن تا زمانی که CT برای رد آسیب به ستون فقرات گردنی انجام نشده، ثابت میشود. برخی از بیمارانی که پس از ضربه به سر در استوپور یا کما به سر می برند، به درمان با داروهایی که می توانند عملکرد سلول های عصبی را بهبود بخشند (به عنوان مثال آمانتادین (Amantadine)) جواب می دهند. چنین درمانی تا زمانی که دارو ادامه بیابد، منجر به بهبود پاسخ عصبی میشود. با این حال چنین درمانی ممکن است در بلندمدت هیچ تغییری در روند بهبودی ایجاد نکند.
در صورت شک به مصرف بیش از حد مواد افیونی، 2 میلی گرم نالوکسان (Naloxone) به صورت درون وریدی تجویز و در صورت لزوم تکرار می شود.
اگر اخیراً (در حدود 1 ساعت پیش) احتمال مصرف بیش از حد دارو وجود داشته باشد، شستشوی معده را می توان پس از انتوباسیون اندوتراکئال (Endotracheal intubation) از طریق یک لوله دهانی-معده ای با قطر بزرگ (به عنوان مثال با محیطی بیش از 33.51 میلی متر) انجام داد. زغال طبی فعال یا شارکول (Charcoal) را می توان در صورت لزوم از طریق لوله دهانی-معده ای وارد کرد.
اختلالات و ناهنجاری های دیگر طبق دستورالعمل درمان می شوند. به عنوان مثال اختلالات متابولیک اصلاح می شود. دمای اصلی بدن ممکن است نیاز به اصلاح داشته باشد (به عنوان مثال خنک شدن برای هیپرترمی شدید، گرم شدن برای هیپوترمی).
انتوباسیون اندوتراکئال یا لوله گذاری داخل نای
بیماران مبتلا به هر یک از موارد زیر برای جلوگیری از آسپیراسیون و اطمینان از تهویه مناسب نیاز به انتوباسیون اندوتراکئال دارند:
- تنفس های کم تعداد، کم عمق یا خس خس کننده.
- اشباع اکسیژن کم (توسط پالس اکسی متری یا اندازه گیری ABG تعیین میشود)
- اختلال در رفلکس های راه هوایی
- عدم واکنش شدید (شامل اکثر بیماران با نمره ای کوچکتر مساوی 8 در مقیاس کمای گلاسکو)
در صورت شک به افزایش ICP، انتوباسیون باید از طریق انتوباسیون دهانی با توالی سریع (Rapid-sequence oral intubation) (با استفاده از داروی فلج کننده) انجام شود تا از طریق انتوباسیون نازوتراکئال (Nasotracheal intubation). انتوباسیون نازوتراکئال در بیماری که به طور خود به خودی تنفس می کند باعث سرفه و رفلکس گگ بیشتر می شود که خود ICP را افزایش می دهد؛ فشاری که به دلیل ناهنجاری های داخل جمجمه از قبل افزایش یافته بود.
برای به حداقل رساندن افزایش فشار درون جمجمه ای که ممکن است در هنگام دستکاری راه هوایی رخ دهد، برخی از پزشکان توصیه می کنند که 1 تا 2 دقیقه قبل از مصرف داروی فلج کننده، لیدوکائین (Lidocaine) را به میزان 1.5 میلی گرم به ازای هر کیلوگرم و به صورت درون وریدی تجویز کنید. بیماران قبل از تجویز فلج کننده، آرام می شوند. اتومیدات (Etomidate) در بیمارانی با فشار خون بالا یا تروما انتخاب مناسبی است زیرا تأثیرات حداقلی بر فشار خون دارد. دوز درون وریدی برای بزرگسالان 0.3 میلی گرم به ازای هر کیلوگرم (یا 20 میلی گرم برای بزرگسالانی با اندازه متوسط) و 0.2 تا 0.3 میلی گرم به ازای هر کیلوگرم برای کودکان است. از طرف دیگر، اگر افت فشار خون بعید به نظر برسد یا وجود نداشته باشد و نیز اگر پروپوفول به راحتی در دسترس باشد، میتوان از پروپوفول به میزان 0.2 تا 1.5 میلی گرم به ازای هر کیلوگرم استفاده کرد.
تزریق درون وریدی سوکسینیل کولین (Succinylcholine) به میزان 1.5 میلی گرم به ازای هر کیلوگرم یا روکورونیوم (Rocuronium) به میزان 1 میلی گرم به ازای هر کیلوگرم معمولاً به عنوان فلج کننده استفاده می شود. فلج کننده ها فقط در مواقعی که برای انتوباسیون ضروری تلقی می شوند و برای جلوگیری از افزایش بیشتر ICP مورد نیاز هستند، باید استفاده شوند. در غیر این صورت از داروهای فلج کننده باید اجتناب شود زیرا داروهایی مانند سوکسینیل کولین می توانند منجر به هیپرترمی بدخیم شوند و یافته ها و تغییرات عصبی را پنهان کنند؛ هرچند که بعید است.
برای ارزیابی کفایت اکسیژن رسانی و تهویه باید از پالس اکسیمتری و ABG (در صورت امکان CO2 در انتهای هوای جاری) استفاده شود.
کنترل ICP
اگر ICP افزایش یابد، پزشکان باید فشار خون رسانی داخل جمجمه ای و مغزی را تحت نظر داشته باشند و آنها را کنترل کنند. هدف حفظ ICP در 20 میلی متر جیوه و فشار خونرسانی مغزی در 50 تا 70 میلی متر جیوه است. ICP معمولاً در کودکان کمتر از بزرگسالان است. در نوزادان، ICP می تواند کمتر از فشار اتمسفر باشد؛ بنابراین کودکان مستقل از دستورالعمل های بزرگسالان ارزیابی می شوند.
کنترل افزایش ICP شامل چندین استراتژی است:
- آرام بخش: ممکن است برای کنترل بی قراری، فعالیت عضلانی بیش از حد (به عنوان مثال به دلیل هذیان) یا درد، که می تواند ICP را افزایش دهد، آرام بخش لازم باشد. پروپوفول اغلب در بزرگسالان استفاده می شود (در کودکان منع مصرف دارد) زیرا شروع و مدت زمان عمل آن سریع است. دوز اولیه تزریق درون وریدی مداوم به میزان 0.3 میلی گرم به ازای هر کیلوگرم در هر ساعت است که در صورت نیاز به تدریج تا 3 میلی گرم به ازای هر کیلوگرم در هر ساعت تیتر می شود. از بولوس آغازین (Initial bolus) استفاده نمی شود. شایع ترین عارضه جانبی آن افت فشار خون است. استفاده طولانی مدت از دوزهای بالا می تواند باعث ایجاد پانکراتیت (Pancreatitis) شود. از بنزودیازپین ها (Benzodiazepines) (به عنوان مثال میدازولام (Midazolam) و لورازپام (Lorazepam)) نیز می توان استفاده کرد. از آنجا که داروهای آرام بخش می توانند یافته ها و تغییرات عصبی را پنهان کنند، استفاده از آنها باید به حداقل میزان برسد و در صورت امکان از مصرف آنها اجتناب شود. در صورت امکان باید از داروهای ضد روان پریشی اجتناب کرد زیرا باعث تاخیر در بهبودی می شوند. برای درمان بی قراری و هذیان ناشی از هیپوکسی از اکسیژن استفاده می شود؛ نه داروهای آرام بخش.
- هایپرونتیلاسیون: هایپرونتیلاسیون باعث هایپوکاپنی یا کاهش غلظت CO2 خون (Hypocapnia) می شود که خود باعث انقباض عروقی شده و در نتیجه جریان خون مغزی به کلی کاهش می یابد. کاهش فشار کربن دی اکسید (PCO2) از 40 میلی متر جیوه به 30 میلی متر جیوه می تواند ICP را حدود 30 درصد کاهش دهد. هایپرونتیلاسیون که PCO2 را به 28 تا 33 میلی متر جیوه کاهش می دهد، ICP را تنها در حدود 30 دقیقه کاهش می دهد. این روش توسط برخی از پزشکان به عنوان یک اقدام موقت، تا زمانی که سایر درمانها اثر بگذارند، استفاده می شود. باید از هایپرونتیلاسیون تهاجمی تا کمتر از 25 میلی متر جیوه خودداری کرد زیرا ممکن است جریان خون مغزی را بیش از حد کاهش داده و منجر به ایسکمی مغزی گردد. ممکن است اقدامات دیگری برای کنترل افزایش ICP انجام شود.
- مایع دادن: از مایعات ایزوتونیک (Isotonic) استفاده می شود. تأمین آب خالص از طریق مایعات درون وریدی (به عنوان مثال دکستروز 5 درصد و سالین 0.45 درصد) می تواند ادم مغزی را تشدید کند و باید از آن اجتناب شود. مصرف مایعات ممکن است تا حدی محدود شوند، اما حجم خون بیماران باید طبیعی نگه داشته شود (Euvolemic). اگر بیماران هیچ نشانه ای از کم آبی یا افزایش میزان مایعات ندارند، مایعات درون وریدی با نرمال سالین را می توان به میزان 50 تا 75 میلی لیتر در ساعت شروع کرد. این میزان را می توان بر اساس سدیم سرم، اسمولالیته، برون ده ادرار و علائم احتباس مایعات (به عنوان مثال ادم) افزایش یا کاهش داد.
- دیورتیک ها (Diuretics): اسمولالیته سرم باید بین 295 تا 320 میلی اسمول بر کیلوگرم نگه داشته شود. برای کاهش ICP و حفظ اسمولالیته سرم، ممکن است دیورتیک های اسمزی (به عنوان مثال مانیتول (Mannitol)) به صورت درون وریدی تزریق شود. این داروها از سد خونی مغزی عبور نمی کنند. آنها آب را در طول یک گرادیان اسمزی از بافت مغز به داخل پلاسما می کشند که در نهایت منجر به تعادل می شود. اثربخشی این داروها پس از چند ساعت کاهش می یابد؛ بنابراین آنها باید برای بیمارانی که وضعیت آنها رو به وخامت است (به عنوان مثال بیماران مبتلا به فتق مغزی حاد) یا قبل از عمل برای بیماران مبتلا به هماتوم استفاده شود. محلول 20٪ مانیتول 0.5 تا 1 گرم به ازای هر کیلوگرم (2.5 تا 5 میلی لیتر به ازای هر کیلوگرم) در مدت 15 تا 30 دقیقه به صورت درون وریدی داده می شود، سپس به میزان لازم (معمولاً هر 6 تا 8 ساعت) در دوز 0.25 تا 0.5 گرم به ازای هر کیلوگرم (1.25 تا 2.5 میلی لیتر به ازای هر کیلوگرم) تجویز می گردد. مانیتول در بیماران مبتلا به بیماری عروق کرونری شدید، نارسایی قلبی، نارسایی کلیوی یا احتقان عروق ریوی باید با احتیاط مصرف شود زیرا این ماده به سرعت حجم داخل عروقی را افزایش می دهد. از آنجا که دیورتیک های اسمزی آب را نسبت به سدیم بیشتر دفع میکنند، استفاده طولانی مدت از مانیتول ممکن است منجر به کاهش آب و افزایش غلظت سدیم خون شود. تزریق فوروزماید (Furosemide) به میزان 1 میلی گرم به ازای هر کیلوگرم و به صورت درون وریدی می تواند آب کل بدن را کاهش دهد، به ویژه هنگامی که باید از پرحجمی (Hypervolemia) گذرای مرتبط با مانیتول اجتناب کرد. هنگام استفاده از دیورتیک های اسمزی تعادل مایعات و الکترولیت ها باید به دقت کنترل شود. محلول سالین 3 درصد یکی دیگر از عوامل اسمزی بالقوه برای کنترل ICP است.
- کنترل فشار خون (Blood pressure/BP): داروهای ضد فشار خون سیستمیک تنها در مواردی که فشار خون شدید باشد (بیش از 180 بر روی 95 میلی متر جیوه) مورد نیاز است. میزان کاهش فشار خون بستگی به شرایط بالینی دارد. فشار خون سیستمیک باید به اندازه کافی بالا باشد تا فشار خونرسانی مغزی را – حتی زمانی که ICP افزایش می یابد – حفظ کند. فشار خون را می توان با کنترل غلظت قطره نیکاردیپین (Nicardipine) (5 میلی گرم در هر ساعت، هر 5 دقیقه 5/2 میلی گرم افزایش می یابد تا به حداکثر میزان 15 میلی گرم در هر ساعت برسد) یا بوسیله بولوس لابتالول (Labetalol) (10 میلی گرم درون وریدی به مدت 1 تا 2 دقیقه، تکرار در هر 10 دقیقه تا اینکه به حداکثر میزان 150 میلی گرم برسد).
- کورتیکواستروئیدها (Corticosteroids): کورتیکواستروئیدها برای درمان ادم مغزی وازوژنیک (Vasogenic brain edema) مفید هستند. ادم وازوژنیک ادمی ناشی از اختلال در سد خونی مغزی است که ممکن است در بیماران مبتلا به تومور مغزی ایجاد شود. ادم سیتوتوکسیک (Cytotoxic edema) ناشی از مرگ و تخریب سلولی است که ممکن است در بیماران مبتلا به سکته مغزی، خونریزی مغزی یا ضربه رخ دهد؛ همچنین ممکن است پس از آسیب هیپوکسیک مغز به دلیل ایست قلبی رخ دهد. درمان با کورتیکواستروئیدها فقط برای تومورها و گاهی آبسه های مغز در صورت وجود ادم وازوژنیک مؤثر است. کورتیکواستروئیدها برای ادم سیتوتوکسیک بی اثر هستند و می توانند گلوکز پلاسما را افزایش داده، ایسکمی مغزی را تشدید کرده و مدیریت دیابت را دچار مشکل کنند. به نظر می رسد برای بیماران بدون ایسکمی مغزی، دوز اولیه دگزامتازون (Dexamethasone) که با 20 تا 100 میلی گرم شروع شده و سپس با 4 میلی گرم یک بار در روز ادامه می یابد، مؤثر است و عوارض جانبی را به حداقل می رساند. دگزامتازون را می توان به صورت درون وریدی یا خوراکی تجویز کرد.
- حذف مایع مغزی نخاعی (Cerebrospinal fluid/CSF): CSF را می توان به آرامی از طریق شنت وارد شده در بطن ها حذف کرد؛ تا به کاهش ICP افزایش یافته کمک کند. CSF با سرعت 1 تا 2 میلی لیتر در دقیقه به مدت 2 تا 3 دقیقه برداشته می شود. از تخلیه مداوم CSF (به عنوان مثال از طریق تخلیه کمری) باید اجتناب شود زیرا ممکن است منجر به فتق مغزی شود.
- وضعیت قرارگیری: قرار دادن بیمار به صورتی که حداکثر خروج وریدی از سر به وجود آید می تواند کمک کند که میزان افزایش در ICP را به حداقل برساند. تا زمانی که فشار خون رسانی مغزی در محدوده مطلوب باقی بماند، قسمت بالایی تخت را می توان تا 30 درجه (طوری که سر بیمار بالای قلب او باشد) بالا برد. سر بیمار باید در خط میانی نگه داشته شود و چرخش و خم شدن گردن به حداقل برسد. ساکشن تراکئال (Tracheal suction)، که می تواند ICP را افزایش دهد، باید محدود شود.
اگر ICP علی رغم اقدامات دیگر برای کنترل آن همچنان افزایش یابد، موارد زیر ممکن است مورد استفاده قرار گیرد:
- هیپوترمی کنترل شده (Titrated hypothermia): وقتی ICP بعد از ضربه سر یا ایست قلبی افزایش می یابد، از هیپوترمی در محدوده 32 تا 35 درجه سانتی گراد برای کاهش ICP به کمتر از 20 میلی متر جیوه استفاده می شود. با این حال، استفاده از هیپوترمی برای کاهش ICP بحث برانگیز است. برخی شواهد (1) نشان می دهد که این درمان ممکن است ICP را در بزرگسالان یا کودکان کاهش ندهد و عوارض جانبی داشته باشد.
- کمای پنتوباربیتال (Pentobarbital coma): پنتوباربیتال می تواند جریان خون مغزی و نیازهای متابولیکی را کاهش دهد. با این حال، استفاده از آن محل مناقشه است زیرا تأثیر آن بر نتیجه بالینی همواره مفید نیست؛ درمان با پنتوباربیتال می تواند منجر به عوارض شود (به عنوان مثال افت فشار خون). در برخی از بیماران مبتلا به افزایش فشار درون جمجمه ای مقاوم (Refractory intracranial hypertension) که به هایپرونتیلاسیون استاندارد و درمان هیپراسمولار پاسخ نمی دهد، پنتوباربیتال می تواند نتیجه کارآمد را بهبود ببخشد. کما با دادن پنتوباربیتال به میزان 10 میلی گرم به ازای هر کیلوگرم و به صورت درون وریدی به مدت 30 دقیقه و سپس 5 میلی گرم به ازای هر کیلوگرم در هر ساعت به مدت 3 ساعت و سپس 1 میلی گرم به ازای هر کیلوگرم در هر ساعت، ایجاد می شود. دوز ممکن است برای سرکوب انفجار فعالیت نوار مغز – که به طور مداوم تحت نظر است – تنظیم شده باشد شود. افت فشار خون شایع است و با تجویز مایعات و در صورت لزوم وازوپرسورها (Vasopressors) مدیریت می شود. سایر عوارض جانبی احتمالی شامل آریتمی، دپرشن میوکارد (Myocardial depression) و اختلال در جذب یا ترشح گلوتامات (Glutamate) است.
- کرانیوتومی دکمپرسیو (Decompressive craniotomy): کرانیوتومی با دوراپلاستی (Duraplasty) می تواند برای ایجاد فضا برای تورم مغز انجام شود. این روش می تواند از مرگ جلوگیری کند، اما نتیجه کارآمد کلی ممکن است چندان بهبود نیابد و در برخی از بیماران منجر به عوارضی مانند هیدروسفالی شود (2). ممکن است برای سکته های مغزی بزرگ با فتق قریب الوقوع، به ویژه در بیماران کمتر از 50 سال، بیشترین فایده را داشته باشد.
مراقبت طولانی مدت
بیماران به مراقبت طولانی مدت و دقیق نیاز دارند. از محرک ها، آرام بخش و مواد افیونی باید اجتناب شود.
تغذیه روده ای با اقدامات احتیاطی برای جلوگیری از آسپیراسیون (به عنوان مثال ارتفاع قسمت بالایی تخت) شروع می شود. در صورت لزوم لوله ژژنوستومی اندوسکوپیک (Endoscopic jejunostomy) از راه پوست قرار می گیرد.
توجه زودهنگام به مراقبت از پوست، از جمله بررسی تخریب به ویژه در نقاط تحت فشار، برای جلوگیری از زخم بستر ضروری است. بیماران برای جلوگیری از زخم بستر نیاز به چرخش مکرر و تغییر موقعیت دارند. گاهی اوقات تشک های بادی مخصوص برای مدیریت زخم بستر مورد نیاز است.
پمادهای موضعی برای جلوگیری از خشک شدن چشم مفید هستند.
تمرینات محدوده حرکتی منفعل که توسط فیزیوتراپیست ها انجام می شود و ضربه زدن یا تقسیم پویای خم کردن (Dynamic flexion splitting) در اندام های انتهایی ممکن است از انقباضات جلوگیری کند. شروع زودهنگام فیزیوتراپی می تواند نتیجه کارآمد را در بیماران مبتلا به پلی نوروپاتی و میوپاتی بهبود بخشد.
همچنین اقداماتی برای پیشگیری از عفونت مجاری ادراری و ترومبوز وریدی عمقی انجام می شود.
ضروریات سالمندی در حالت کما
بیماران مسن ممکن است به دلیل عوامل زیادی، از جمله موارد زیر، مستعد کما، تغییر هوشیاری و هذیان باشند.
- توانایی شناختی کمتر؛ به دلیل تاثیرات مغزی مرتبط با سن و/یا اختلالات مغزی قبلی.
- ریسک بالای تداخلات دارویی که بر مغز تاثیر می گذارد؛ به دلیل مصرف همزمان بیش از یک دارو (Polypharmacy).
- افزایش خطر تجمع دارو و اثرات آن بر مغز؛ به دلیل تأثیر افزایش سن بر کاهش عملکرد ارگان های مسئول متابولیسم و دفع مواد.
- خطر بیشتر مصرف ناصحیح دوز دارو؛ به دلیل مصرف همزمان بیش از یک دارو همراه با رژیم های پیچیده دوز آنها.
- وجود اختلالات همراه (مانند دیابت شیرین، فشار خون بالا، بیماری کلیوی)
مشکلات نسبتاً جزئی، مانند کم آبی بدن و عفونت های مجاری ادراری، می تواند هوشیاری را در افراد مسن تغییر دهد.
وضعیت ذهنی و مهارت های ارتباطی در بیماران مسن ممکن است به خطر بیفتد، که تشخیص لتارژی و ابتاندیشن را دشوار می کند.
تأثیر افزایش سن بر کاهش توانایی شناختی و انعطاف پذیری عصبی می تواند روند بهبودی آسیب مغزی را مختل کند.
نکات کلیدی درمورد کما (اغما) و اختلال هوشیاری
- کما و اختلال هوشیاری مستلزم اختلال عملکرد هر دو نیمکره مغزی یا اختلال عملکرد دستگاه فعال کننده مشبک است.
- تظاهرات آن شامل ناهنجاری های چشمی (به عنوان مثال نگاه خیره هماهنگ و غیرطبیعی، پاسخ های مردمک، و/یا رفلکس های اکولوسفالیک یا اکولووستیبولار)، علائم حیاتی (به عنوان مثال تنفس های غیرطبیعی) و عملکرد حرکتی (به عنوان مثال شل شدن، همی پارزی، آستریکسی، میوکلونوس چند کانونی، وضعیت دکورتیکه یا دسربره)میباشد.
- اخذ شرح حال کامل از وقایع قبلی بسیار مهم است. از شاهدان و بستگان بیمار در مورد دوره زمانی تغییر وضعیت ذهنی و علل احتمالی (به عنوان مثال سفرهای اخیر، خوردن وعده های غذایی غیر معمول، قرار گرفتن در معرض عفونت های احتمالی، مصرف مواد مخدر یا الکل، ضربه احتمالی) سوال کنید.
- معاینه فیزیکی کامل انجام دهید؛ شامل معاینه کامل سر و صورت، پوست و اندام های انتهایی و معاینه کامل عصبی (با تمرکز بر سطح هوشیاری، چشم ها، عملکرد حرکتی و رفلکس های تاندونی عمیق) و به دنبال آن آزمایش خون و ادرار مناسب، غربالگری برای سم شناسی و اندازه گیری گلوکز پلاسما با استفاده از خون بند انگشت.
- به محض پایداری شرایط بیمار، CTبدون کنتراست انجام دهید.
- از راه تنفسی، تنفس و گردش خون مناسب اطمینان حاصل کنید.
- در صورت کم بودن میزان گلوکز پلاسما، تیامین داخل عضلانی یا درون وریدی و گلوکز درون وریدی و در صورت مشکوک به مصرف بیش از حد مواد افیونی نالوکسان درون وریدی تجویز شود.
- ICP را با استفاده از استراتژی های مختلف کنترل کنید، که ممکن است شامل تجویز آرام بخش (در صورت لزوم) برای کنترل بی قراری، هایپرونتیلاسیون موقت، مایعات و دیورتیک ها برای حفظ حجم طبیعی خون و داروهای ضد فشار خون برای کنترل فشار خون باشد.
- علت را درمان کنید.